فصل برادة الالمنيوم عن برادة النحاس
(1) التخلص من برادة الالومنيوم
- إذا كان لدينا مخلوط من برادة الألومنيوم وبرادة النحاس فأنه يتم التخلص من برادة الالومنيوم والحصول على برادة النحاس عن طريق التفاعل مع حمض الهيدروكلوريك المخفف HCl
Cu/Al + HCl → AlCl3 + H2 + Cu
- أضف محلول حمض الهيدروكلوريك المخفف إلى مخلوط برادة الألومنيوم وبرادة النحاس حيث يتفاعل حمض الهيدروكلوريك المخفف مع الألومنيوم ولا يتفاعل مع النحاس وبترشيح ناتج التفاعل نحصل على النحاس.
- حيث تتم التفاعلات الآتية:
↑2ِAl + 6HCl → 2AlCl3 + 3H2
Cu + HCl → no reaction
ملاحظات هامة على تفاعل HCl المخفف مع الألومنيوم
- لا يحدث تفاعل HCl المخفف مع الألومنيوم بسرعة وذلك لأن معدن الألومنيوم دائماً محاط بطبقة من أكسيد الألومنيوم Al2O3 وهذه الطبقة هى التى تحمى الألومنيوم من التفاعل مع الهواء.
- لذلك فأن حمض HCl المخفف سيأخذ بعض الوقت للتفاعل مع الألومنيوم.
- تفاعل حمض HCl المخفف مع الألومنيوم سيكون خطير لأنه سيتصاعد غاز الهيدروجين المتصاعد نتيجة التفاعل.
لماذا لا يتفاعل النحاس مع حمض الهيدروكلوريك المخفف
- لأن النحاس لا يستطيع أن يحل محل هيدروجين الحمض لأن الهيدروحين يسبق النحاس فى متسلسلة النشاط الكيميائي وبذلك لا يحدث التفاعل
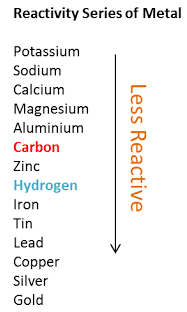
ثانياً/ التخلص من برادة النحاس
- حمض النيتريك المخفف عامل مؤكسد قوي يؤكسد المعادن الغير نشطة مثل النحاس والفضة ولا يتفاعل مع الألومنيوم
- لذلك بتفاعل حمض النيتريك المخفف مع مخلوط برادة النحاس وبرادة الألومنيوم يتفاعل مع النحاس ويظل الألومنيوم فى القاع يمكن ترشيحه.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Al + HNO3 → no reaction
- تكون نترات النحاسوز المتكونة من التفاعل زرقاء غامقة ويتصاغد غاز NO2 البني المحمر.
ثالثاً/ فصل برادة النحاس عن برادة الألومنيوم والإبقاء عليهم
- يتم فصل برادة النحاس عن برادة الألومنيوم بإستخدام أجهزة تسمى Al - Cu separator

- يمكن رؤية الفيديو التالي : separation of Cu and Al for recycling