الصيغة الأولية ( الوضعية ) Empirical formula
هي صيغة تبين نوع العناصر الداخلة فى تركيب الجزئ من خلال إظهار أبسط نسبة لعدد ذرات العناصر فيه .
الصيغة الجزيئية Molecular formula
- يطلق عليها القانون الحقيقي لأنها تدل على عدد ونوع ذرات العناصر الداخلة في تكوين الجزئ الواحد.
- لا تعطي كيفية ارتباط وتوزيع الذرات بالنسبة لبعضها فكثير من الجزئيات تشترك فى الصيغة الأولية وتختلف فى الصيغة الجزيئية مثل المركبات Ethylene - Cyclohexane - Cyclopentane جميعها تملك الصيغة الأولية CH2 وقد تتساوي الصيغة الأولية والجزيئية في بعض المركبات خصوصا فى المركبات الأيونية مثل MgCl2 , KI , AgCl
خطوات تعيين الصيغة الأولية
(1) تحليل نوعي Qualitative analysis ( معرفة أنواع العناصر المكونة لجزئ )
(2) تحليل كمي Quantitative analysis ( معرفة النسب الوزنية للعناصر المكونة لجزئ)
(3) عدد المولات = وزن العنصر / الوزن الذري .
(4) نوجد أبسط نسبة عددية لعدد المولات بقسمة الأعداد على أصغر عدد .
خطوات تعيين الصيغة الجزيئية :
(1) تحليل نوعي ثم تحليل كمي
(2) وزن العنصر = النسبة المئوية للعنصر x الوزن الجزيئي
(3)عدد الذرات في الجزئ = وزن العنصر / الوزن الذري للعنصر .
طريقة أخرى:
1- نوجد الصيغة الأولية .
2- عدد مرات التضاعف = الوزن الجزيئي / مجموع أوزان ذرات الصيغة الأولية .
3- الصيغة الجزيئية = عدد مرات التضاعف x الصيغة الأولية
مثال (1): مركب وزنه 100g يحتوي عناصر S ,O, Sr كتلة Sr = 47.7 g و S = 17.46 g والوزن الجزيئي للمركب 184 g/m
أوجد الصيغة الجزيئية للمركب؟
الحل:
أولاً: حساب الصيغة الأولية للمركب
(1) وزن المركب 100 جم فيكون:
Sr ⇒ 47.7 g
S ⇒ 17.46 g
(17.46 - O ⇒ 34.84 g (100 - 47.7
(2) حساب عدد المولات لكل عنصر
عدد المولات لكل عنصر = وزن العنصر فى المركب / الوزن الذري للعنصر
الوزن الذري لعنصرالسترونشيوم = 87.62g/mol
الوزن الذري لعنصر الكبريت = 32.06g/mol
الوزن الذري لعنصرالأكسجين = 16g/mol
فيكون عدد المولات لكل عنصر كالتالي:
Sr ⇒ 47.7 g / 87.62 gmol = 0.544
S ⇒ 17.46 g / 32.06 g/mol = 0.544
O ⇒ 34.84 g / 16 g/mol = 2.178
(3) نقسم على أقل نسبة من نسب العناصر السابقة
أقل نسبة للعناصر هي 0.544 لذلك نقسم جميع النسب السابقة على 0.544 فيكون:
Sr ⇒ 0.544 / 0.544 = 1
S ⇒ 0.544 / 0.544 = 1
O ⇒ 2.178 / 0.544 = 4
وعلى ذلك تكون الصيغة الأولية (الصيغة الوضعية) للمركب هي SrSO4
ثانياً: حساب الصيغة الجزيئية
الكتلة المولية للصيغة الوضعية SrSO4
= (4 × 16) + 32.06 + 87.62 = 183.68g/mol تقريباُ
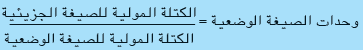
= 184/183.68 = 1
الصيغة الجزيئية = الصيغة الوضعية × وحدات الصيغة الوضعية
الصيغة الجزيئية = 1 × SrSO4= SrSO4
الصيغة الجزيئية هي SrSO4
حل السؤال: مركب صيغته الاولية NO2 وكتلته الموليه 92 جم /مول فكم تكون صيغته الجزيئية؟
الحل:
الكتلة المولية للصيغة الوضعية NO2
= (2 × 16) + 14 = 46g/mol
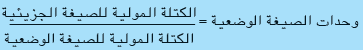
= 92/46 = 2
الصيغة الجزيئية = الصيغة الوضعية × وحدات الصيغة الوضعية
الصيغة الجزيئية = 2 × N2O4= NO2
الصيغة الجزيئية هي N2O4