المركبات العضوية القاعدية
- القواعد العضوية هي مركبات عضوية تتصرف كقاعدة ودائماً تكون قواعد لويس حيث تتبرع بزوج واحد من الألكترونات.
العوامل المؤثرة فى قوة القواعد العضوية
(1) الشحنة Charge
- الشحنة التقديرية الموجبة على الذرة تقلل الكثافة الألكترونية وبالتالي يكون من الصعوية أرتباطها بالبروتون +H
- الشحنة التقديرية السالبة على الذرة تزيد الكثافة الألكترونية وبالتالي يكون من السهولة أرتباطها بالبروتون +H
- الكاتيونات أكثر حامضية من المركبات المتعادلة والأنيونات أكثر قاعدية من المركبات المتعادلة.
(2) السالبية الكهربية Electronegativity
- عندما تمتلك الذرة قدرًا أكبر من السالبية الكهربية ، فهذا يعني أن الذرة أكثر جشعًا للإلكترونات.
- إذا كانت الذرة التي تتبرع بالإلكترونات للبروتون تتمتع بسالبية كهربائية عالية ، فإن الجزيء الذي يحتوي على تلك الذرة تكون قاعديته أقل.
- مثال: NH3 مقابل F- الذرات المتبرعة للإلكترون هي N , F. لأن F لديها سالبية كهربية أعلى من N ، فهي أقل رغبة في التبرع بالإلكترونات للبروتون. هذا يقلل احتمالية تكوين روابط F مع H ، مما يعني أن F هي الأقل قاعدية من N
- يكون الترتيب فى القاعدية كالتالي:
Carbanions > nitrogen anions > oxyanione > halides
(3) التهجين Hybridisation
- يكون ترتيب القاعدية كالتالي حسب نوع التهجين:
SP3 > SP2 > SP
- كلما زادت نسبة (s) كلما زادات السالبية الكهربية وقلت القاعدية.
(4) الحجم الذري Atomic size
- كلما كانت الذرات ذات حجم ذري صغير ولها كثافة إلكترونية عالية فأن القاعدية تزداد.
- كلما كانت الذرات ذات حجم ذري كبير ولها كثافة إلكترونية صغيرة فأن القاعدية تقل.
- الفلور أقل حجما وأكثر كثافة ألأكترونية من البروم لذلك فأن الفلور أكثر قاعدية من البروم.
(5) التأثير الحثي Inductive effect
- التأثير الحثي يحدث عندما الذرات تأخذ أو تعطي الألكترونات من ذرة أخرى مجاورة.
- الذرات التى لا تتبرع بالألكترونات إلى البروتونات تؤثر تأثيراً كبيراً على القاعدية.
(6) الرنين Resonance
- الرنين دائماً يؤدى الى عدم تمركز الألكترونات على الذرة وهذا يقلل الكثافة الألأكترونية ويجعل الجزئ أقل قاعدية.
- إذا كانت الذرة القاعدية غير مشتركة فى الرنين فأن هذا لا يؤثر على قاعدية المركب.
الأمينات Amines من أهم المركبات العضوية القاعدية
- الأمينات هي مركبات تحتوي على ذرات النيتروجين المرتبطة مع ذرات الكربون في سلاسل أليفاتية أو حلقات آروماتية.
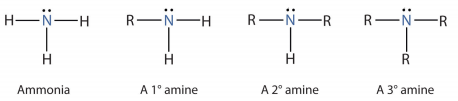
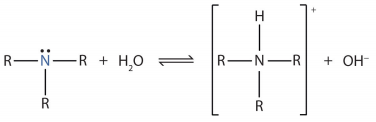
- الأمينات هى مركبات عضوية قاعدية نظراً لوجود زوج الألكترونات الحر على ذرة النيتروجين وتستقبل البروتون من الماء وتكون أيون موجب وأيونات الهيروكسيل طبقاً للمعادلة التالية:
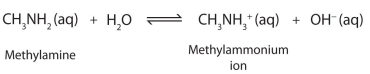
مثال:
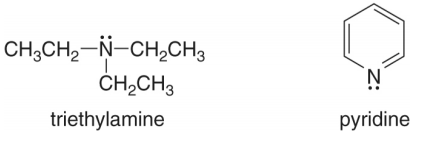
- ومن أمثلة الأمينات التى تتصرف قواعد هى :
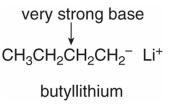
المركبات المحتوية أيون الكربانين Carbanions
- القواعد القوية هى التى تحتوى على شحنات سالبة مثل أيونات الكربانين.
- من أشهر الأمثلة على ذلك هو مركب butyllithium
كما يمكنك تحميل العديد من الكتب فى الكيمياء العضوية والبحث بالتفصيل عن موضوعك من خلال هذا الرابط:
كتب فى الكيمياء العضوية