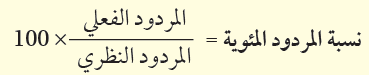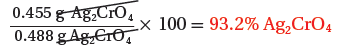النسبة المئوية للناتج Percent Yield
- عندما تُستَخدم المعادلة الكيميائية لحساب كمية الناتج التي يُمكن أن تتكون خلال التفاعل الكيميائي، فإن هذه الكمية تُسمى بالكمّية النظرية للناتج Mass of Theoretical Yield وهي أقصى كمّية للناتج التي من الممكن الحصول عليها من الكمّيات المعطاة للموادّ المتفاعلة.
- أمّا عمليًّا، ّ فإن الكمية التي تتكون هي أقل من الكمية النظرية وتُسمى الكمّية الفعلية للناتج ،Mass of Actual Yield وهي الكمّية التي تتكون فعلياً أثناء إجراء التفاعل في المختبر.
النسبة المئوية للناتج هي مقياس لكفاءة التفاعل وتُعرف كما يلي:

- غالبًا ما تكون النسبة المئوية للناتج ّ أقل من % 100 وذلك لعدة عوامل منها:
(1) عدم الاتحاد الكلي للمواد المتفاعلة.
(2) استعمال مواد متفاعلة غير نقية.
(3) حدوث بعض التفاعلات الجانبية إلى جانب التفاعل الأصلي.
(4) فقدان جزء من كمية الناتج عن طريق ترشيحه أو نقله من إناء إلى آخر.
(5) قد تلتصق المواد المتفاعلة والناتجة- في الحالة السائلة -على سطوح الأوعية أو تتبخر.
(6) قد تنتج مواد أخرى غير متوقعة بسبب تفاعلات التنافس التي تقلل من كمية الناتج المرغوب فيه .
أمثلة محلولة
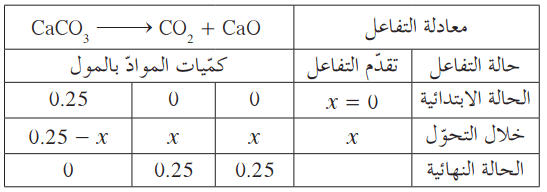
مثال (1): تتحلل كربونات الكالسيوم تحت تأثير الحرارة كما هو مبين في المعادلة:
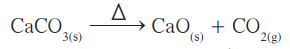
(أ) ما هي الكمية النظرية لأكسيد الكالسيوم التي قد تنتج إذا تم تسخين الكالسيوم؟
(ب) ما هي النسبة المئوية لناتج أكسيد الكالسيوم إذا ّ تكون 13g منه؟
طريقة التفكير في الحل
- اذكر المعلوم وغير المعلوم كالتالي:
المعلوم: كتلة كربونات الكالسيوم المتفاعلة = 25g ، الكتلة الفعلية لأكسيد الكالسيوم الناتجة = 13g
غير المعلوم: الكتلة النظرية لأكسيد الكالسيوم الناتجة .
- باستخدام جدول التفاعل يُمكن حساب عدد مولات أكسيد الكالسيوم ومن ثم حساب الكتلة النظرية الناتجة.
الحل:
عدد مولات كربونات الكالسيوم
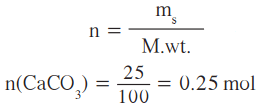
- الكتلة النظرية لأكسيد الكالسيوم:
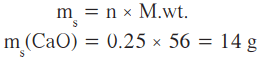
- النسبة المئوية للناتج:
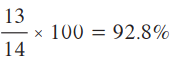
مثال (2): تتكون كرومات الفضة الصلبة Ag2CrO4 عند إضافة كرومات البوتاسيوم K2CrO4 إلى محلول يحتوى على 5g من نترات الفضة AgNO3.
(1) احسب المردود النظري لكرومات الفضة Ag2CrO4
(2) احسب نسبة المردود المئوية إذا كانت كتلة كرومات الفضة Ag2CrO4 الناتجة فعلياً عن التفاعل هي 0.455g
تحليل المسألة
المعطيات والمطلوب
كتلة نترات الفضة = 0.5g AgNO3 ، المردود الفعلي = 0.455g AgCrO4
المردود النظري = ?? Ag2CrO4 ، المردود المئوي = ?? Ag2CrO4
حساب المطلوب
أولاً/ حساب المردود النظري
(1) نكتب المعادلة الموزونة ونحدد المعطيات والمطلوب
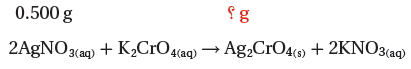
(2) استخدم الكتلة المولية لتحويل جرامات AgNO3 إلي عدد مولات AgNO3
(الكتلة المولية لنترات الفضة) 1mol → 169.9g
(الكتلة المستخدمة فى التفاعل) mol → 5g ??
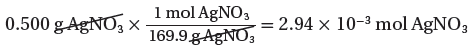
(3) استخدم النسبة المولية لتحويل عدد مولات AgNO3 إلي عدد مولات Ag2CrO4
من المعادلة الموزونة نجد أن:
2mol AgNO3 → 1mol Ag2CrO4
2.94x10-3 mol AgNO3 → ?? mol Ag2CrO4
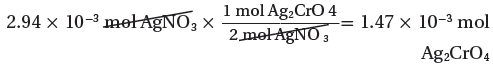
(4) نحسب كتلة المردود النظري للمركب Ag2CrO4
(الكتلة المولية لللمركب) 1mol → 331.7g
(الكتلة الناتجة من التفاعل) 1.47x10-3mol → ?? g
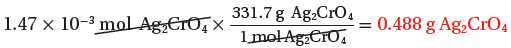
ثانياً/ نسبة المردود المئوية