العزم القطبي Dipole Moment
- يسمى أيضاً بالعزم ثنائي القطب
- فى مركب فلوريد الهيدروجين HF نجد أنه مركب تساهمي برابطة قطبية وذلك لأن الفرق فى السالبية الكهربية بينهما أقل من 1.7 وعلى ذلك يكون هناك تحول فى الكثافة الألكترونية من H إلى F لأن ذرة F أكثر أكثر كهروسالبية من ذرة (H)
- يمثل اتجاة ميل الكثافة الألكترونية بالسهم الموجود كما بالصورة ويدل على اتجاه ميل الكثافة
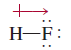
ويمكن تمثيل فصل الشحنات الناتج كما يلي:
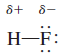
حيث δ (دلتا) وهي ترمز إلى شحنة جزئية
- ويمكن إثبات فصل الشحنات بمجال كهربائي وعند تشغيل المجال الكهربائي توجه جزيئات HF أطرافها السالبة نحو اللوح الموجب في حين توجه أطرافها الموجبة نحو اللوح السالب ويمكن ملاحظة ترتيب الجزيئات تجريبياً.
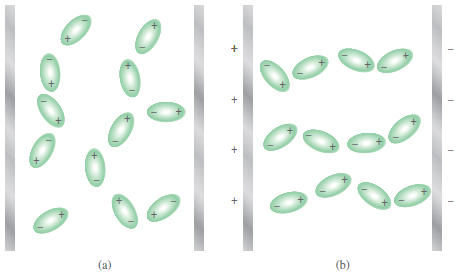
قياس العزم القطبي
- تقاس قطبية الرابطة كمياً بالعزم القطبي (m) وهو حاصل ضرب الشحنة (Q) فى المسافة الفاصلة بين الشحنات (r)
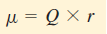
- وحدة قياس العزم القطبي هي الديباي (D) ومعامل التحويل هو:
1D = 3.336 x 10-30 C m
حيث C هو الكولوم ، m متر
ملاحظات هامة على العزم القطبي
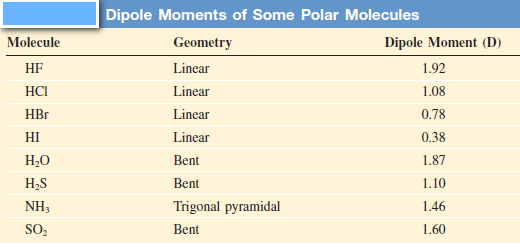
- الجزئيات ثنائية الذرة المكونة من عناصر مختلفة (مثل HCl , CO , NO2) ولكل منها عزم ثنائي القطب بالجزيئات القطبية.
- الجزئيات ثنائية الذرة المكونة من عناصر متشابهة (مثل F2, O2 , H2) فهي أمثلة للجزئيات غير القطبية لأنه ليس لها عزم ثنائي القطب (العزم القطبي = صفر)
- أن قطبية روابط الجزئ المكون من ثلاث ذرات أو أكثر وشكله الهندسي هما اللذان يحددان فيما إذا كان عزمه ثنائي القطب أم لا حتى إذا كانت الروابط قطبية.
أمثلة توضيحية على العزم القطبي
- فأنه ليس بالضرورة أن يكون للجزئ عزم ثنائي القطب فمثلاً ثاني أكسيد الكربون (CO2) هو جزئ ثلاثي الذرات ولهذا فإن الشكل الهندسي له أما خطياً linear وإما زاوياً bent

- تبين الأسهم اتجاه الكثافة الألكترونية من ذرة الكربون الأقل كهروسالبية إلى ذرة الأكسجين الأكثر كهروسالبية.
- وفي هذة الحالة فإن العزم ثنائي القطب للجزئ الكامل يتكون من عزمي الرابطتين أى العزوم القطبية المفردة فى الرابطة القطبية C=O
- إن عزم الرابطة كمية متجهة بمعنى أن لها مقداراً واتجاهاً والعزم ثنائي القطب المقيس يساوى محصلة عزوم الروابط.
- عزمى الرابطتين فى جزئ CO2 الخطي متساويتان فى المقدار ولكن متضادتان فى الأتجاه فأن مجموع عزم ثنائي القطب يساوي صفراً.
- ومن ناحية أخري CO2 زاوياً فإن عزمى الرابطتين يدعم بعضه بعضاً ولذلك يمكن أن يكون للجزئ عزم ثنائي القطب.
- تجريبياً وجد أن CO2 غير قطبي ولهذا نستنتج أن جزئ CO2 خطي وقد أكدت تجارب أخرى الشكل الخطي لهذا الجزئ.
أهمية العزم القطبي
- يمكن استخدام العزم ثنائي القطب للتمييز بين الجزيئات التى لها الصيغة نفسها ولكن لها أشكال مختلفة فمثلاً الجزيئان الآتيان موجودان فى الطبيعة ولهما الصيغة C2H2Cl2 نفسها وعدد الروابط ونوعها نفسهما ولكن لهما أشكال جزيئية مختلفة.

ولأن جزئ cis-dichloroethylene قطبي فى حين أن جزئ trans-dichloroethylene غير قطبي فأننا نستطيع التمييز بينهما بسهولة من خلال قياس العزم ثنائي القطب
- يبين الجدول التالي العزوم ثنائية القطب لكثير من الجزئيات
مسائل محلولة على العزم القطبي
تنبأ إذا كانت الجزئيات الآتية لها عزم قطبي:
(أ) BrCl (ب) BF3 (مثلث مسطح) (جـ) CH2Cl2 (رباعي الأوجة)
الحل:
تذكر أن:
- عزم ثنائي القطب يعتمد على كل من الفرق فى السالبية الكهربية للعناصر فيه وشكله الهندسي.
- يمكن أن يملك الجزئ روابط قطبية (إذا كان هناك فرق في الكهروسالبية بين عناصر الرابطة) ولكن قد لا يكون له عزم ثنائي القطب إذا كان له شكل هندي متماثل.
(أ) الجزئ: BrCl كلوريد البروم
لأن جزئ BrCl ثنائي الذرة فأن له شكلاً هندسياً خطياً.
- الكلور أكثر كهروسالبية من البروم ولهذا فإن جزئ IBr قطبي والطرف السالب هو الكلور.
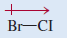
ولهذا فأن للجزئ عزماً ثنائي القطب
(ب) BF3 (مثلث مسطح) ثلاثي فلوريد البورون
لأن الفلور أكثر كهروسالبية من البورون فأن كلاً من رابطة B - F في BF3 قطبية وعزم الروابط الثلاثة متساوٍ.
- لكن التماثل في الشكل المثلث المستوي يعني أن عزوم الروابط الثلاثة تلغي بعضها بعضاً.
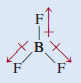
وهذا يشبه جسماً يسحب بالأتجاهات المبينة على طول عزم الروابط الثلاثة فإذا كانت القوي متساوية فإن الجسم لن يتحرك.
- لذلك أن BF3 ليس له عزم ثنائي القطب ( العزم القطبي = صفر) فهو جزئ غير قطبي.
(جـ) CH2Cl2 (رباعي الأوجة) كلوريد الميثيلين
شكل لويس لجزئ كلوريد الميثلين هو:
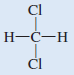
- هذا الجزئ مشابه للجزئ CH4 فهو رباعي الأوجة بشكل عام ولكن لأن الروابط ليست جميعها مشابهة فإن هناك ثلاث زوايا مختلفة HCH , HCCl , ClCCl وهذة الزوايا قريبة من بعضها ولكنها لا تساوي 109.5o ولأن الكلور أكثر كهروسالبية من الكربون ، والكربون أكثر كهروسالبية من الهيدروجين فإن العزوم ثنائية القطب لا تلغي بعضها بعضاً والجزئ له عزم ثنائي القطب.
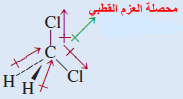
- ولهذا فإن CH2Cl2 جزئ قطبي