فى بداية الأمر يجب رسم تمثيل لويس للنشادر حتى يمكن معرفة أزواج الإلكترونات الرابطة والأزواج غير الرابطة.
رسم تركيب لويس للأمونيا NH3
- لمراجعة خطوات رسم تركيب لويس لأى جزئ يمكن الرجوع إلى هذا الرابط: قواعد رسم تراكيب لويس
(1) يتكون جزئ الأمونيا NH3 من ذرة نيتروجين وثلاث ذرات هيدروجين ، ولكون الهيدروجين ذرة جانبية فلابد ان يكون النيتروجين هو الذرة المركزية.
(2) يجب أن نجد العدد الأجمالي لألكترونات التكافؤ المتوافرة للترابط:

هناك 8 إلكترونات تكافؤ موجودة للترابط.
(3) حدد عدد أزواج الترابط الكلي . وللقيام بذلك نقسم عدد الإلكترونات المتوافرة على (2)
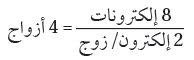
يتوافر أربعة أزواج من الإلكترونات للترابط.
(4) ضع زوجًا رابطًا من الإلكترونات بين ذرة النيتروجين المركزية وكل ذرة هيدروجين جانبية لتكوين رابطة أحادية.
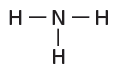
(5) حدد عدد الأزواج غير المرتبطة المتبقية.
اطرح عدد الأزواج المستخدمة في هذه الروابط من العدد الإجمالي للألكترونات المتوافرة للترابط
4 أزواج (المجموع الكلي) – 3 أزواج مستخدمة = زوج واحد غير رابط
- يكون الزوج المتبقي هو زوج غير رابط ويجب أن يضاف إلى الذرة المركزية أو إلى الذرات الجانبية. ولأن ذرات الهيدروجين تقبل رابطة واحدة فقط فإنها لا تستقبل زوجًا غير رابط من الإلكترونات.
(6) ضع الزوج غير المرتبط المتبقي على ذرة النيتروجين المركزية.

تشارك كل ذرة هيدروجين بزوج واحد من الإلكترونات وتشارك كل ذرة النيتروجين المركزية بثلاثة أزواج من الإلكترونات، ولها زوج واحد غير رابط للحصول على حالة الثمانية المستقرة.
السؤال: ضع علامة صح أو خطأ:
يوجد في جزئ NH3 ثلاث أزواج رابطة وزوجين غير رابطة ( X )
وذلك حسب تمثيل لويس لجزئ النشادر نجد أن هناك ثلاث أزواج من الألكترونات الرابطة وزوج واحد فقط من الألكترونات الغير رابطة.