جهد التأين (طاقة التأين) Ionization Energy
مقدار الطاقة اللازمة لإزالة أو فصل أقل الإلكترونات ارتباطاً بالذرة المفردة وهى في الحالة الغازية
-A + energy → A+ + e
- نحتاج مثلاً إلى طاقة قدرها 8.64 × 19-10 جول لانتزاع إلكترون من ذرة الليثيوم في الحالة الغازية.
- طاقة التأين الأولي : هي الطاقة اللازمة لانتزاع أول إلكترون من الذرة المتعادلة.
- الشكل التالي يوضح طاقة التأين الأولى لعناصرالمجموعات الرئيسية بالكيلوجول/مول:
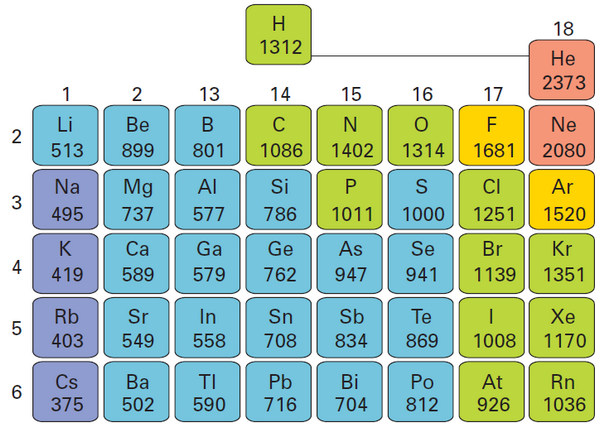
- تمثل كل مجموعة من النقاط المتصلة في الشكل السابق إلى العناصر الموجودة في دورة واحدة.
- تكون طاقة تأين الفلزات منخفضة جداً لذا تميل إلى تكوين أيونات موجبة.
- أما طاقة تأين عناصر المجموعة 18 فهي عالية جدًّا، لذلك لا تكوّن أيونات في أغلب الأحيان؛ حيث إن التوزيع الإلكتروني المستقر لهذه العناصر يحد من نشاطها الكيميائي.
- تشير طاقة التأين إلى مدى قوة تمسُّك نواة الذرة بإلكترونات تكافئها. لذا تشير طاقة التأين الكبيرة إلى أن القوة التي تمسك النواة بهذه الإلكترونات كبيرة أيضًا. ولذا تميل الذرات التي قيم طاقة تأينها كبيرة إلى تكوين الأيونات السالبة.
- على سبيل المثال لطاقة تأين الليثيوم المنخفضة أهمية في صنع بطاريات الحاسوب؛ فسهولة خسارة الإلكترونات يساعد البطارية على إنتاج قدرة كهربائية أكبر.
انتزاع أكثر من إلكترون
- قد تنتزع إلكترونات أخرى بعد انتزاع الإلكترون الأول من الذرة.
- تسمى الطاقة التي يتطلبها انتزاع إلكترون ثانٍ من أيون أحادي الشحنة الموجبة بطاقةَ التأين الثانية. وتُسمى الطاقة التي يتطلبها انتزاع إلكترون ثالث من أيون ثنائي الشحنة الموجبة بطاقةَ التأين الثالثة.
- قد يوجد للعنصر أكثر من جهد تأين لأنه من الممكن إزالة إلكترون أو أثنين أو ثلاثة من الذرة فقد يوجد للذرة جهد تأين أول وثان وثالث.... الخ
- جهد التأين الأول للغازات النبيلة مرتفع جداً لإستقرار نظامها الإلكتروني حيث يصعب إزالة إلكترون من مستوي طاقة مكتمل
- جهد التأين الثاني أكبر من جهد التأين الأول وذلك لزيادة شحنة النواة عن شحنة الألكترونات المتبقية فى الذرة مما يزيد من قوة جذب النواة للإلكترونات
- الجهد الـتأين الثالث يكون أكبر من جهدى التأين الأول والثاني وذلك لأنه قد يتسبب فى كسر مستوى طاقة مكتمل كما فى ذرة الماغنسيوم.

- الجدول التالي يوضح طاقات التأين لعناصر الصوديوم - الماغنسيوم - الألومنيوم
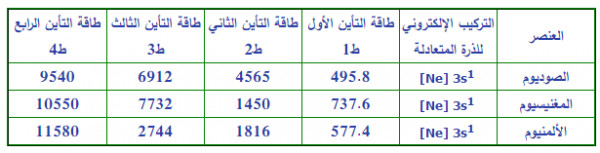
حل السؤال: أحد العناصر الافتراضية الآتية تمتلك أكبر طاقة تأين تاني: A13 / B12 / C11 / E10 ؟
- نكتب التوزيع الألكتروني للعناصر التالية:
[E10 : 1s2 , 2s2 , 2p6 = [Ne10
C11 : 1s2 , 2s2 , 2p6 , 3s1 = [Ne10] , 3s1
B12 : 1s2 , 2s2 , 2p6 , 3s2 = [Ne10] , 3s1
A13 : 1s2 , 2s2 , 2p6 , 3s2 , 3p1 = [Ne10] , 3s1 3p1
- من التوزيع الألكترونى نجد أن العنصر E10 هو الأعلى طاقة تأين أولى وذلك لأن مستوى الطاقة الأخير مكتمل بالألكترونات وعلى ذلك فأن الطاقة اللازمة لانتزاع إلكترون من مستوى طاقة مكتمل كبيرة جداً.
- من التوزيع الألكترونى أيضاً نجد أن العنصر C11 هو الأعلى طاقة تأين ثاني وذلك لأنه يسبب فى كسر مستوى طاقة مكتمل بالألكترونات (2p) وهذا يحتاج إلى طاقة كبيرة.
- تكون إجابة السؤال: العنصر الأفتراضي C11