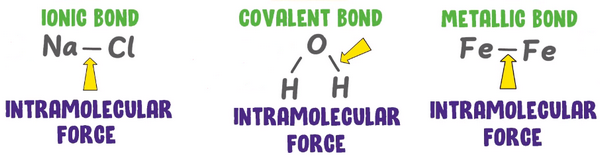
أولاً/ قوي الترابط الجزيئية Intramolecular forces
- تسمى قوى التجاذب التي تربط بين جسيمات المادة بروابط أيونية وتساهمية وفلزية بقوى الترابط الجزيئية intramolecular forces ويعنى المقطع intra بمعنى (داخل) بينما المقطع molecular بمعنى (جزيئية) ويقصد بالجزيئية الذرات والأيونات والجزيئات.
- هذا النوع من القوى يحدث داخل الجزئ نفسه مثل الرابطة الأيونية التى تحدث بين الصوديوم والكلور فى جزئ كلوريد الصوديوم.
ثانياً/ القوي بين الجزيئات Intermolecular forces
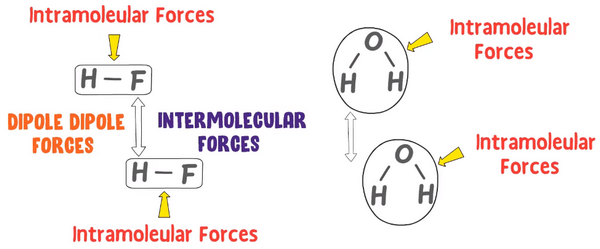
لا تمثل قوى الترابط الجزيئية كافة قوى التجاذب بين الجسيمات بل هناك قوى تجاذب أخرى تسمى القوى بين الجزيئات intermolecular forces وهي قوى بينية تربط بين جسيمات متشابهة، مثل تلك التي بين جزيئات الماء، أو بين جسيمات مختلفة مثل ذرات الكربون في الجرافيت ، وجسيمات السليلوز في الورق.
- والبادئة (Inter) تعنى (between) أي باللغة العربية (بين)
- هذا النوع من القوى يحدث بين الجزئيات مثل القوى التى تربط بين جزئ NaCl وجزئ NaCl آخر.
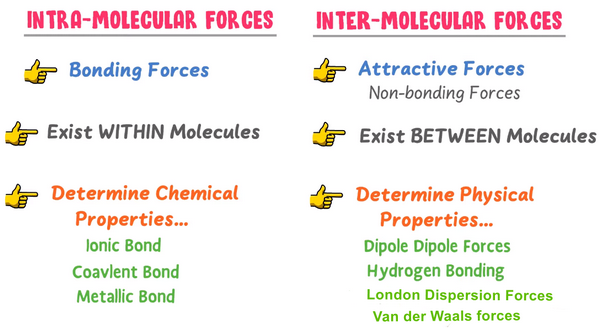
- هناك عدة أنواع من القوى بين الجزيئات، ومنها:
(1) قوى فاندرفال Van der Waals forces وتختلف هذة القوى في قوتها ، ولكنها أضعف من قوى الربط التي تربط بين الذرات في الجزيء.
(2) القوى الضعيفة بين الجزيئات غير القطبية التي تسمى قوى التشتت London Dispersion Forces
(3) القوى بين الأطراف المشحونة بشحنات مختلفة في الجزيئات القطبية والتي تسمى قوى ثنائية القطب Dipole-Dipole Attractive Forces . وكلما زادت قطبية الجزيء زادت هذه القوى.
(4) الرابطة الهيدروجينية Hydrogen bonds : وهي أقواها،وتتكون بين ذرة هيدروجين تقع في نهاية أحد الأقطاب وذرة نيتروجين أو أكسجين أو فلور في جزيء آخر.
وعلى الرغم من اختلاف هذه القوى في قوتها بعضها عن بعض، إلا أن القوى بين الجزيئات كلها أضعف من قوى الترابط داخل الجزيئات.
مقارنة بين القوى البين جزيئية والقوي بين الجزئيات
هل الرابطة التناسقية تعتبر من قوى الترابط الجزيئية أو من قوى الترابط بين الجزيئات
بمعنى آخر هل الرابطة التناسقية داخل الجزئ نفسه أم بين جزئ وجزئ آخر.
الرابطة التناسقية Co - ordinate bond
- الرابطة التناسقية هي نوع من أنواع الروابط التساهمية تتكون نتيجة مساهمة ذرة مع الأخرى بزوج من الإلكترونات غير المشتركة في روابط.
- تسمى الذرة التي تقدم زوجا من الإلكترونات بالذرة المانحة، والذرة الأخرى تسمى بالذرة المستقبلة.
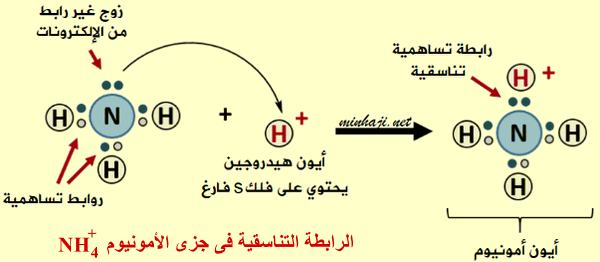
الرابطة التناسقية فى جزئ الأمونيوم +NH4
يمكن لذرة النيتروجين في جزئ الأمونيا NH3 أن تقدم زوجاً غير رابط من الألكترونات إلى الفلك الفارغ في أيون الهيدروجين الموجب ، فتتكون رابطة تناسقية بين النيتروجين والهيدروجين ويتكون أيون الأمونيوم +NH4
الرابطة التناسقية جزئ أول أكسيد الكربون CO
- تحتوى ذرة الكربون على 4 الكترونات فى مستوى طاقتها الخارجى فى حيت تحتوى ذرة الأكسجين على 6 إلكترونات حيث ترتبط أربع الكترونات من الكربون مع أربعة الكترونات من الأكسجين وتتكون رابطتين تساهمتين ليصل الكربون إلى التركيب الثماني لأقرب غاز خامل.
- ولكن يظل هناك زوج من الألكترونات غير مرتبط على ذرة الأكسجين حيث تتبرع به ذرة الأكسجين لذرة الكربون وتتكون ما يسمى بالرابطة التناسقية.
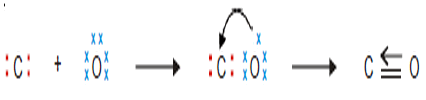
من الأمثلة السابقة تتضح الرؤية بأن الروابط التناسقية تحدث بين داخل الجزئ نفسه.