الروابط التساهمية التناسقية (التساندية) Coordinate - Covalent Bond
- عرفنا في أحد الموضوعات أن الرابطة التساهمية ناتجة عن مساهمة كل ذرة بإلكترون ليتكون زوج الكتروني رابط . أي أن مصدر الزوج الإلكتروني هو الذرتين المرتبطتين.
- أما عندما يكون مـصـدر الزوج الإلكتروني هو أحـد الذرتين المرتبطتين فإن الرابطة عند ذلك تسمى الرابطة التساهمية التناسقية ( Coordinate - Covalent Bond ) أو تسمى الرابطة التسائدية ( Dative Bond) .
- لا تختلف الرابطة التساهمية عن الرابطة التناسقية إلا من حيث المنشأ.
- تعريف الرابطة التساهمية التناسقية: هي رابطة بين ذرتين تساهم بالزوج الرابط فيها ذرة واحدة فقط .
كيفية تكون الرابطة التساهمية التناسقية
(1) تتكون الرابطة بين ذرتين إحـداهـمـا لديها زوج أو أكثر من الأزواج الحرة والأخرى لديهـا نقص في الإلكترونات.
(2) الذرة التي تمنح الزوج الإلكتروني تسمي الذرة المانحة أو المعطية (donor atom) ولذلك تحمل شحنة موجبة.
(3) الذرة التي تستقبل الزوج الإلكتروني تسمى الذرة المستقبلة ( acceptor atom ) ولذلك تحمل شحنة سالبة.
(4) يرمز للرابطة التناسقية بسهم يتجه من الذرة المعطية إلى الذرة المستقبلة . والهدف من هذا السهم هو تمييز الروابط التناسقية عن الروابط التساهمية.
من الأمثلة على الذرات المعطية ( الذرات التي تمتلك الزوج الحر) هي ذرة الأكسجين (O) أو النيتروجين (N).

- من الأمثلة على الذرات المستقبلة ( الذرات التي لديها نقص في الإلكترونات ) هي ذرة البورون (B) أو الالمنيوم (Al) او ابون الهيدروجين (+H).

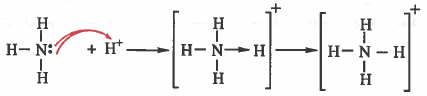
(1) الرابطة التناسقية في أيون الأمونيوم (+NH4)

(1) تمنح ذرة النيتروجين في جزيء النشادر الزوج الحر إلى أيون الهيدروجين لتحمل بعد ذلك نرة النيتروجين شحنتين موجبتين
(2) أيون الهيدروجين يـحـتـاج إلى إلكتـرونين ليصل إلى تركب الغـاز الـخـامـل (الهليـوم) لذلك يستقبل أيون الهيدروجين الزوج الحر من النيتروجين ، ونتيجة لذلك يصبح على الهيدروجين شحنة سالبة واحدة.
ملاحظات
- يحمل أيون الأمونيوم (+NH4) شحنة موجبة وهي محصلة الشحنات الناتجة.
- يرمز للرابطة التناسقية بسهم يتجه من الذرة المانحة للإلكترونات (النيتروجين) إلى الذرة المستقبلة للإلكترونات (الهيدروجين)
- عند تكون الرابطة بين النشادر وأيون الهيدروجين تصيح جميع الروابط بين النيتروجين والهيدروجين (N - H) تساهمية متكافلة (متماثلة في الطول والقوة).
- يستطيع الامونيا تكوين روابط تساندية ، بينما لا يستطيع الأيون (+NH4) القيام بذلك والسبب لأن الذرة المركزية (النيتروجين) في الأمونيا و (NH3) تحمل زوج غیر رابط . اما الذرة المركزية (النيتروجين) في أيون الامونيوم (+NH4) فلا تحمل زوج غیر رابط.