درجة الغليان Boiling Point (Tb)
- درجة الغليان هي درجة الحرارة التي يكون عندهـا ضـغط بخـار السائل مساوياً للضغط الخارجي المؤثر على السائل.
- عند الوصول لدرجة الغليان تثبت درجة الحرارة مع استمرار التسخين حتى يتبخر كل السائل ، وذلك لأن الطاقة الحرارية الممتصة يتم استغلالها في تحويل السائل إلى بخار عند درجة الغليان.
العوامل المؤثرة على درجة الغليان
(1) قوى التجاذب بين الجزيئات
- كلما زاد التـجـاذب بين جزيئات السائل تزداد درجـة غليانه وذلك لازدياد الطاقة اللازمة لفصل الجزيئات بعضها عن بعض.
- فمثلاً الجزيئات القطبـيـة درجـات غليانها أعلى من الجزيئات غير القطبية المتقاربة في الوزن الجزيئي.
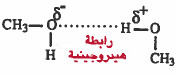
- وكذلك وجود روابط هيدروجينية بين الجزيئات القطبية يزيد من تجاذبها وبالتالي تزداد درجة غليانها.
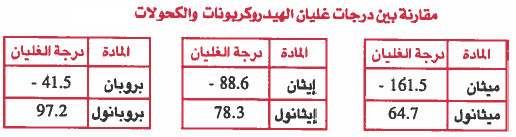
- درجة غليان الميثانول CH3OH اعلى من الميثان CH4 وذلك لأن الميثانول يحـتـوي بين جزيئاته على روابط هيدروجينية ، أما الميثان فهو غير قطبي أصلاً .
- درجة غليان الإيثانول C2H5OH أعلى من الإيثر الميثيلي CH3OCH3 وذلك لأن الإيثانول يوجد بين جزيئاته روابط هيدروجينية بعكس الإيثر الميثيلي.
(2) حجم الجزيء (الوزن الجزيئي)
- كما سبق وأخذنا أن قوى لندن تزداد بزيادة الوزن الجزيئي أو العدد الذري أو الحجم.
- فمثلاً درجة غليان الإيثان CH3CH3 أكبر من الميلان CH4 ، لاحظ أن الإيثان أكبر حجماً (يحتوي على عدد أكبر من الإلكترونات) ، وبالتالي فإن قوى لندن فيه تكون أكبر .
(3) الضغط الخارجي
- تعتمد درجة غليان سائل ماء على الضغط الخارجي ، أي أنه كلما زاد الضغط الخارجي تزداد درجة الغليان.
تطبيق: هناك أواني تستخدم للطهي تسمى أواني الضغط ، حيث يتم عدم السماح للبخـار الموجود داخل جهاز الضغط بالخروج فيزداد الضغط في الداخل وتزداد درجة الغليان إلى أعلى من (°100C) وهذا يساعد على زيادة سرعة الطهي.