يمكن تقسيم المحاليل تامة الامتزاج إلى:
(۱) محاليل مثالية.
(۲) محاليل لا مثالية.
المحاليل المثالية Ideal Solutions
تمتاز المحاليل المثالية بما يلي:
(1) تتشابه قوى التجاذب الأصلية بين A - A وكذلك بين B - B مع قوى التـجـاذب الناتجة بين A - B .
[A - A , B - B = A - B]
لهذا فإنه:
في المحاليل المثـالـيـة حـجم المذاب السائل VA وحجم المذيب السائل VB يساوي تمـامـاً الحجم الناتج بعد المزج VTOTAL دون زيادة أو نقصان.
[ VTOTAL = VA + VB ]
في المحاليل المثاليـة مـيـل الـجـزيئات للهروب (للتبخر) من المحلول يساوي ميل الجزيئات للهروب في السوائل النقية.
(2) الضغط البخاري الكلي للسائلين بعد المزج PTOTAL يساوي مجموع الضغوط البخارية للسائل المذاب PA والسائل المذيب PB بعد المزج
[ Pt = PA + PB ]
(3) المحاليل المثالية لا يصاحبها تغير في درجة الحرارة.
وهذا يعني أن عملية المزج لا ماصة ولا طاردة للحرارة ، أي أن التغير في الإنثالبي يساوي صفر (0 = ΔH).
(4) المحاليل المثالية تتبع قانون راؤول
إذ يمكن إيجاد الضغط البخاري لكل سائل بعد المزج باستخدام قانون راؤول .
قانون راؤول Raoult's law
ينص قانون راؤول على ما يلي:
(عند درجة حرارة معينة يكون الضغط البخاري الجزئي للسائل في المحلول يساوي ضغطه البخاري نقياً مضروباً في كسره المولي في المحلول).
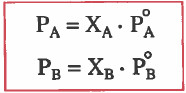
وحيث أن : PTOT = PA + PB فإنه يمكن التوصل للقوانين التالية:
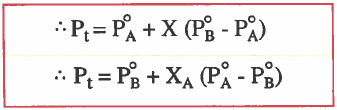
ولا ننسي أهمية القوانين التالية:
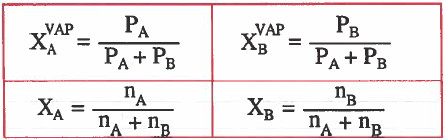
حيث أن :
PA = ضغط السائل A في المحلول
PB = ضغط السائل B في المحلول
PAo = ضغط السائل A نقياً قبل المزج
PBo= ضغط السائل B نقياً قبل المزج
XA = الكسر المولي السائل A في المحلول
XB = الكسر المولي السائل B في المحلول
nA = عدد المولات السائل A
nB =عدد المولات السائل B
Pt = الضغط البخاري الكلي للمحلول.
XAVAP = الكسر المولي المركب البخاري A
XBVAP = الكسر المولي للمركب البخاري B
اشتقاق قانون راؤول
يمكن اشتقاق القانون التالي:
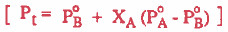
حيث أن:
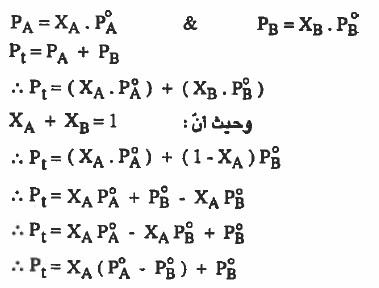
أمثلة على محاليل مثالية
(1) ميثانول وإيثانول
(2) بنزول وتولوين
(3) ميثانول وماء
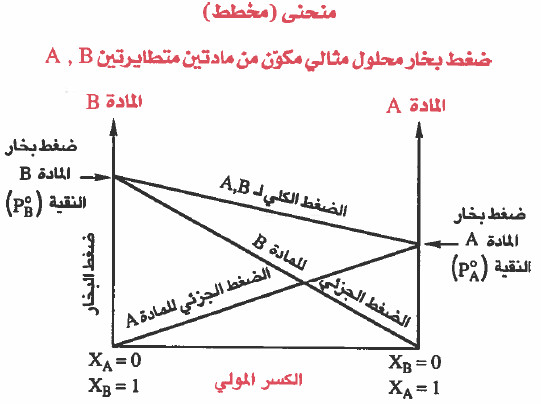
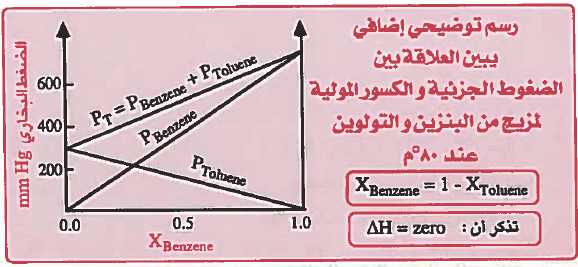
ملاحظة: يمكن من الرسم تحديد قيمة PA , PB , Ptotal عند كسر مولي معين.
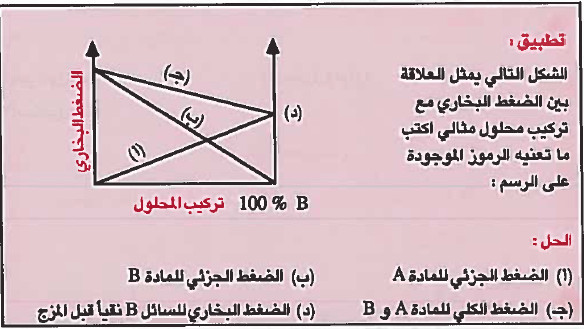
ملاحظة: المحاليل المثالية نادرة الوجود ، ولذلك تستخدم كنظام مقارنة.
ما الفرق بين المحلول المثالي والغاز المثالي
- الغاز المثالي هو الذي تكون فيه قوى التجاذب والتنافر بين جزيئاته معدومة.
- المحلول المثالي : هو المحلول الذي تكون قوى التجاذب والتنافر بين جزيئاته متساوية تماماً مع قوى التجاذب بين جزيئات مكونات المحلول قبل المزج.