مثال (5): حسب التفاعل التالي:
2NO + Br2 → 2NOBr
ومن التجربة تبين أن قانون سرعة التفاعل هو:
rate = k [NO]2 [Br2]
فأوجد رتبة التفاعل للمواد المتفاعلة ورتبة التفاعل الكلية.
الحل:
رتبة التفاعل للمادة NO هي 2
رتبة التفاعل للمادة Br2 هي 1
رتبة التفاعل الكلية = 2+ 1 = 3
التفاعل من الدرجة الثالثة .
مثال (6) حسب التفاعل التالي :
H2O2 + 3I- + H+ → I3- + H2O
ومن التجربة تبين أن قانون سرعة التفاعل هو
rate = k [H2O2] [I-]
فأوجد رتبة التفاعل للمواد المتفاعلة ورتبة التفاعل الكلية
الحل:
رتبة التفاعل للمادة H2O2 هي 1
رتبة التفاعل للمادة I- هي 1
رتبة التفاعل للمادة +zero = H
رتبة التفاعل الكلية = 1 + 1 = 2
التفاعل من الدرجة الثانية
ملاحظة: نظراً لأن رتبة التفاعل لـ (+H)من الدرجة صفر فإن زيادة أو نقصان تركيز (+H) لا يؤثر على سرعة التفاعل.
مثال (7): حسب التفاعل التالي:
2Br- + H2O2 + 2H+ → Br2+ 2H2O
فإذا كانت رتبة التفاعل هي الأولى لكل من المواد المتفاعلة فاجب عما يلي:
(1) أكتب معادلة معدل سرعة التفاعل
(2) اكتب قانون سرعة التفاعل
(3) ما رتبة التفاعل الكلية
الحل:
(۱) معادلة معدل سرعة التفاعل:
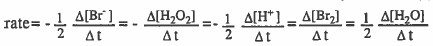
(۲) قانون سرعة التفاعل :
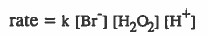
(۳) رتبة التفاعل = 1 + 1 + 1 = 3
مثال (8): إذا كان لدينا التفاعل التالي:
A → B
وعند مضاعفة التركيز سوف يتضاعف سرعة التفاعل ، فكم تصبح رتبة التفاعل للمادة A .
الحل:
قانون سرعة التفاعل الافتراضية قبل التغيير:
rate = k [A]X
قانون سرعة التفاعل الافتراضية بعد التغيير:
2rate = k (2[A])X
بقسمة المعادلة الثانية على المعادلة الأولى :
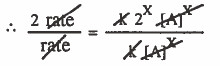
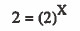
X = 1
رتبة التفاعل للمادة (A) من الدرجة الأولى.
قانون سرعة التفاعل هو:
rate = k [A]
نستنتج ، انه عندما يؤدي مضاعفة التركيز لمادة ما إلى مضاعفة سرعة التفاعل فإن رتبة التفاعل بالنسبة لهذه المادة من الدرجة الأولى.
مثال ( 9): إذا كان لدينا التفاعل التالي:
A → B
وعند مضاعفة التركيز مرتان سوف تتضاعف سرعة التفاعل أربع مرات ، فكم تصبح رتبة التفاعل للمادة A .
الحل:
قانون سرعة التفاعل الافتراضية قبل التغيير:
rate = k [A]X
قانون سرعة التفاعل الافتراضية بعد التغيير:
4rate = k (2[A])X
بقسمة المعادلة الثانية على المعادلة الأولى:
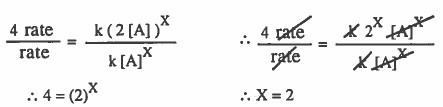
رتبة التفاعل للمادة (A) من الدرجة الثانية.
قانون سرعة التفاعل هو:
rate = k [A]2
نستنتج : انه عندما يؤدي مضاعفة التركيز لمادة ما إلى مضاعفة سرعة التفاعل أربع مرات فإن رتبة التفاعل بالنسبة لهذه المادة من الدرجة الثانية.