العلاقة بين Kp و Kc
Relationship between Kp & Kc
- يمكن إيجاد العلاقة بين Kp , Kc بأحد الطريقتين التاليتين:
الطريقة الأولى لإيجاد العلاقة بين Kp , Kc (الطريقة الاستنتاجية)
استنتاج العلاقة بين Kc و Kp :
حسب التفاعل التالي :
aA (g) + b B (g) = c C (g) + d D (g)
نكتب في البداية قانون ثابت الاتزان Kp , Kc لكل تفاعل:
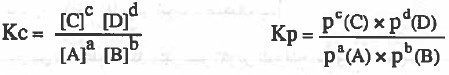
نعوض في قانون Kp بالاستفادة من القانون: [ P = CRT ]
P = الضغط ، C = التركيز ، R = ثابت الغازات ، T= درجة الحرارة المطلقة
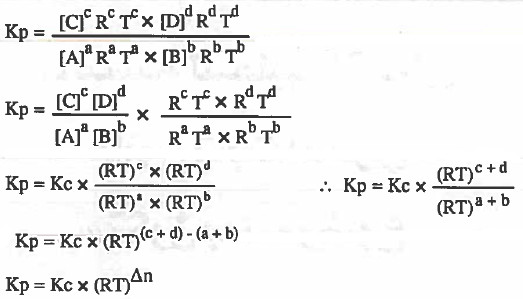
حيث أن: Δn الفرق بين عدد مولات الغازات الناتجة وعدد مولات الغازات المتفاعلة.
مسائل محلولة على الطريقة الاستنتاجية
مثال (1): استنتج العلاقة بين (Kc) و (Kp) للتفاعل التالي :
CH4 (g) + 2O2 (g) = CO2 (g) + 2 H2O (g)
الحل:
نكتب في البداية قانون ثابت الاتزان Kp ,Kc لكل تفاعل:

نعوض في قانون Kp بالاستفادة من القانون: [ P = CRT ]
P = الضغط ، C = التركيز ، R = ثابت الغازات ، T= درجة الحرارة المطلقة
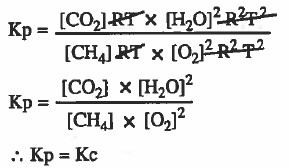
نستنتج ، أنه في حالة تساوي أعداد مولات المتفاعلات والنواتج الغازية فإن : Kp = Kc
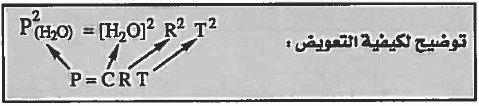
مثال (2): استنتج العلاقة بين (Kc) و (Kp) للتفاعل التالي:
4CH3OH (g) = 4 CO (g) + 8 H2 (g)
الحل:
نكتب في البداية قانون ثابت الاتزان Kp ,Kc لكل تفاعل:
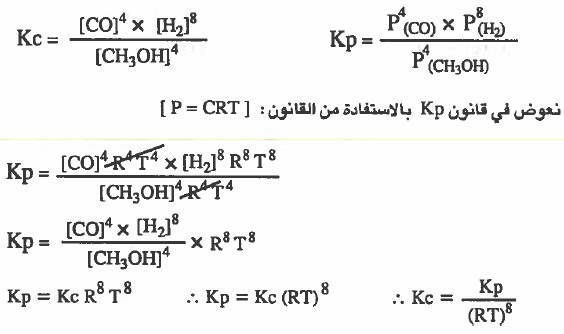
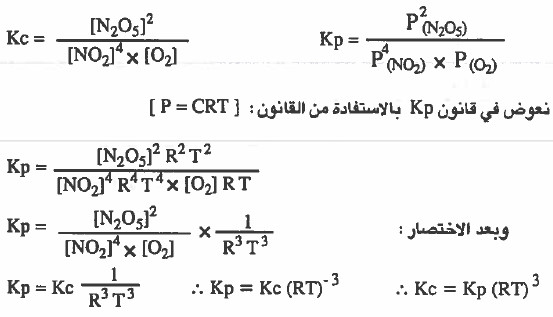
مثال (3): استنتج العلاقة بين (Kc) و (Kp) للتفاعل التالي:
4NO2 (g) + O2 (g) = 2 N2O5 (g)
الحل:
نكتب في البداية قانون ثابت الاتزان Kp ,Kc لكل تفاعل: