نجد أن العوامل المؤثرة على حالة الاتزان هي:
(1) التركيز (2) الضغط (3) درجة الحرارة (4) المواد الحفازة
مبدأ لوشاتيليه في التفاعلات
إذا اثر مـؤثـر مـا مثل درجة الحرارة أو الضغط أو التركيز على تفاعل كيميائي في حالة اتزان فإن التفاعل يسير في الاتجاه الذي يقاوم هذا المؤثر.
أثر التركيز على حالة الاتزان
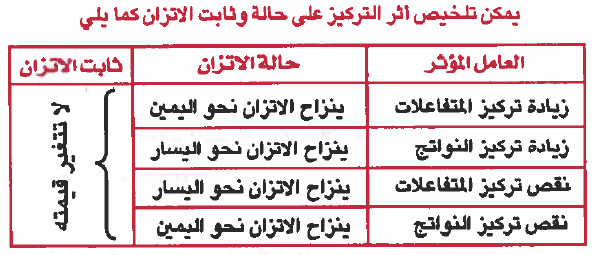
- يمكن تلخيص أثر التركيز على حالة وثابت الاتزان كما يلي:
- ولتوضيح اثر التركيز على حالة الاتزان سوف نأخذ التفاعل المتزن التالي:
A (aq) + B (aq) = C (aq) + D (aq)
- إذا إضيف كمية من المادة (A) سوف ينتج عن ذلك زيادة في تركيز (كمية) المواد الناتجة ويمكن تفسير ذلك حسب مبدأ لوشاتيليه كما يلي:
عند زيادة كـمـيـة (تركـيـز) المادة (A) فإن هذا يعني زيادة في تركيز المواد المتفاعلة وبذلك سوف يختل الاتزان ، ورد الفعل الطبيعي هو استهلاك (تقليل) جـزء من المادة (A) حيث تتفاعل جزء من المادة (B) مع كمية من المادة (A) لينتج زيادة من المواد الناتجة (C, D)
ملاحظة هامة:
(تغيير الضغط الجزئي لأحد المواد المتفاعلة أو الناتجة له نفس تأثير تغيير التركيز على الاتزان)
مسائل محلولة على أثر التركيز على حالة الاتزان
مثال (1): حسب التفاعل التالي:
CO (g) + NO2 (g) = CO2 (g) + NO (g)
بين أثر التغيرات التالية:
(1) زيادة كمية (NO2)
(2) نقص كمية (NO2)
(3) زيادة كمية (CO2)
(4) نقص كمية (CO2)
على ما يلي :
(أ) حالة الاتزان
(ب) كميات المواد المتفاعلة و المواد الناتجة
(ج) قيمة ثابت الاتزان
الحل:
(أ) بالنسبة لتأثير التغيرات على حالة الاتزان:
(1) زيادة كمية (NO2) : يؤدي إلى انزياح الاتزان نحو اليمين (باتجاه المواد الناتجة)
(2) نقص كمية (NO2) : يؤدي إلى انزياح الاتزان نحو اليسار (باتجاه المواد المتفاعلة)
(3) زيادة كمية (CO2) : يؤدي إلى انزياح الاتزان نحو اليسار (باتجاه المواد المتفاعلة)
(4) نقص كمية (CO2) : يؤدي إلى انزياح الاتزان نحو اليمين (باتجاه المواد الناتجة)
(ب) بالنسبة التأثير التغيرات على كميات المواد المتفاعلة والناتجة:
(1) عندما تزداد كمية (NO2):
تنقص كمية (CO) ، تزداد كمية (CO2) ، تزداد كمية (NO)
(2) عندما تنقص كمية (NO2):
تزداد كمية (CO) : تنقص كمية (CO2) ، تنقص كمية (NO)
(3) عندما تزداد كمية (CO2) :
تنقص كمية (NO) ، تزداد كمية (CO) ، تزداد كمية (NO2)
(4) عندما تنقص كمية (CO2) :
تزداد كمية (NO) ، تنقص كمية (CC) ، تنقص كمية (NO)
(جـ) بالنسبة لتأثير التغيرات على قيمة ثابت الاتزان
زيادة أو نقص كمية أو تركيز أحد المواد المتفاعلة أو الناتجة لا يؤدي إلى تغير في قيمة ثابت الاتزان.