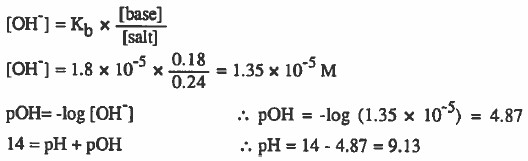تأثير الايون المشترك Common Ion Effect
- إذا كان لدينا محلول لحمض ضعيف مثل حمض الخل:
+CH3COOH + H2O → CH3COO- + H3O
- وعند إضـافـة خـلات الصوديوم إلى محلول الحمض السابق في البداية يتفكك الملح حسب المعادلة التالي:
+CH3COONa → CH3COO- + Na
أي أن كمية أيون الخلات (-CH3COO) سوف تزداد وبذلك سوف يختل الاتزان.
- وحتى نعود إلى حالة الاتزان سوف يتفاعل جزء من أيونات الهيدرونيوم (+H3O) لإنتاج زيادة من حمض الخليك ( CH3COOH) ونتيجة لنقص أيونات الهيدرونيوم سوف تقل قيمة pH .
- وللمعلومية فإن أيون (-CH3COO) يعتبر أيون مشترك لحمض الخل ( CH3COOH) .
- ومن ذلك نستنتج أن إضافة أيونات إلى تفاعل )حمضي او قاعدي ) متزن يؤدي إلى تغيير في قيمة الأس الهيدروجيني (pH)
- ويمكن إيجاد الأس الهيدروجيني لمزيج من حمض ضعيف وملحه أو قاعدة ضعيفة وملحها باستخدام معادلة هندرسون - هاسلبالخ كما يلي:

مسائل محلولة على تأثير الأيون المشترك
مثال(1): محلول حمض الخل ذو التركيز 0.01M ، فاحسب الأس الهيدروجيني pH لهذا المحلول.
Ka = 1.85 x 10-5
وعند إضـافـة مـحـلـول خـلات الصوديوم CH3COONa ذو التـركـيـز 0.03M إلـى مـحـلـول حمض الخل فاحسب قيمة pH للمزيج حينما يكون الحجمان المضافان متساويين.
الحل:
- نحسب pH محلول حمض الخل أولاً:
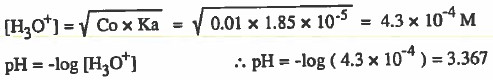
- نحسب pH لمحلول لمزيج حمض الخل وملحه:
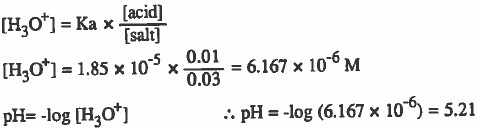
لاحظ أنه عند إضافة ملح خـلات الصوديوم إلى حمض الخل ان قيمة pH قد زادت ، أي ان الحمضية نقصت.
مثال( 2): أحسب pH محلول الامونيا (0.18M NH3) ، فإذا أضيف محلول كلوريد الأمونيوم ( 0.18M NH4Cl) إلى محلول الأمونيا فاحسب الـ pH لهذا المحلول حينما يكون الحجمان المضافان متساويين.
(Kb = 1.8 x 10-5)
الحل:
- نحسب pH لمحلول الأمونيا أولاً:
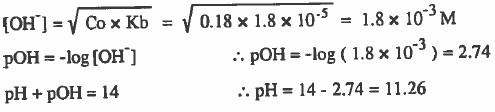
- نحسب pH لمحلول لمزيج الأمونيا وملحها: