طريقة أعداد الأكسدة لوزن معادلات الأكسدة والاختزال
يمكن وزن معادلات الاكسدة والاختزال بطريقة اعداد الأكسدة حسب الخطوات الآتية كما يلي:
الخطوة (1): وزن الذرات التي حصل بها الأكسدة والاختزال إذا كانت غير موزونة.
الخطوة (2): إيجاد اعداد الأكسدة لجميع الذرات في التفاعل ، ومن هنا سوف يتبين لك العنصر الذي تأكسد والعنصر الذي اختزل.
الخطوة (3): صل العنصر الذي حصل له أكسدة مع ناتج تأكسده بخط ، واكتب على الخط عدد الإلكترونات المفقودة ، وصل العنصر الذي حصل له اخـتـزال مع ناتج اخـتـزالـه بخط واكتب على الخط عدد الإلكترونات المكتسبة.
الخطوة (4): توحـيـد عـدد المعامل الحـسـابـي للإلكترونات في حالة عـدم تسـاوي عـدد الإلكترونات المفقودة مع المكتسبة حيث نضرب المواد المشتركة في الأكسدة في عـدد مـا ، والمواد المشـتـركـة فـي الاخـتـزال في عـدد مـا بـحـيـث تـتـسـاوى اعداد الإلكترونات المفـقـودة والمكتسبة.
الخطوة (5): يوازن النقص في ذرات الأكسجين بإضـافـة جـزيء مـاء عن كل ذرة أكسجين ناقصة.
الخطوة (6): يوازن النقص في ذرات الهيدروجين كما يلي:
- في الوسط الحمضي يوازن النقص في ذرات الهيدروجين بإضافة ايون هيدروجين (+H) كل ذرة هيدروجين ناقصـة.
- في الوسط القاعدي يوازن النقص في ذرات الهيدروجين بإضافة جزيء ماء (H2O) عن عن كل ذرة هيدروجين ناقصة، وفـي الـجـهـة الأخـرى يضاف أيون هيدروكسيد (-OH) عن كل جزيء ماء تمت إضافته.
الخطوة (7): نختصر المتكرر في المواد المتفاعلة والناتجة.
مسائل محاولة على طريقة أعداد الأكسدة لوزن معادلات الأكسدة والاختزال
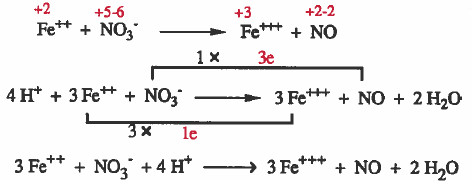
مثال (1): زن المعادلة التالية وسط حمضي بطريقة تغير أعداد الأكسدة:
Fe2+ + NO3- → Fe3+ + NO
الحل:
(1) الذرات التي حصل بها الأكسدة والاختزال موزونة ولذا ننتقل للخطوة التالية:
(2) نوجد أعداد الأكسدة لجميع الذرات كما يلي:

(3) نصل المادة الذي حصل لها أكسدة (++Fe) مع ناتج الأكسدة (+++Fe) بخط مع كتابة عدد الإلكترونات المفقودة على الخط.
ونصل المادة الذي حصل لـهـا اخـتـزال ( -NO3) مع ناتج الاختزال (NO) بخط مع كتابة عدد الإلكترونات المكتسبة على الخط.
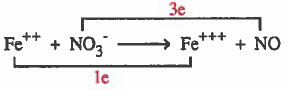
(4) نساوي اعداد الإلكترونات بضرب المواد المشتركة في الأكسدة ( +++Fe++, Fe) في العدد (3) ، وبضرب المواد المشتركة في الاختزال ( NO3-, NO) في العدد (1).

(5) نوازن النقص في ذرات الأكسجين بإضافة جزيء ماء عن كل ذرة أكسجين ناقصة.
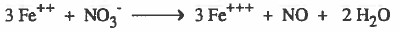
(6) نوازن النقص في ذرات الهيدروجين بإضافة (+H) عن كل ذرة هيدروجين ناقصة.
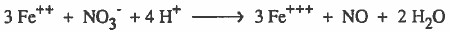
يمكن حل المثال السابق بدون كتابة الخطوات النظرية كما يلي:
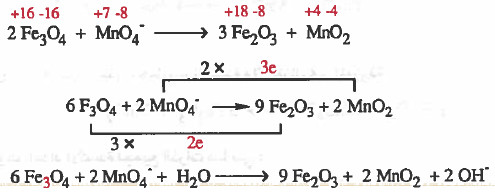
مثال (2): زن المعادلة التالية في وسط قاعدي بطريقة التغير في أعداد الأكسدة:
Fe3O4 + MnO4- → Fe2O3 + MnO2
الحل:
(1) نزن جميع الذرات التي حصل بها الأكسدة والاختزال غير الموزونة.

(2) نوجد اعداد الأكسدة لجميع الذرات كما يلي:

(3) نصل المادة الذي حصل لها أكسدة (Fe3O4) مع ناتج الأكسدة (Fe2O3) بخط مع كتابة عدد الإلكترونات المفقودة على الخط.
ونصل المادة الذي حصل لـهـا اخـتـزال (-MnO4) مع ناتج الاختزال (MnO2) بخط مع كتابة عدد الإلكترونات المكتسبة على الخط.
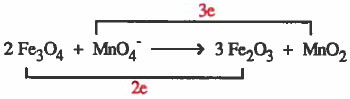
(4) نساوي أعداد الإلكترونات بضرب المواد المشتركة في الأكسدة (Fe3O4, Fe2O3 ) في (3) ، ونضرب المواد المشتركة في الاختزال (MnO4-, MnO2) في العدد (2).

(5) نوازن النقص في ذرات الأكسجين بإضافة جزيء ماء عن كل ذرة اكسجين ناقصة.
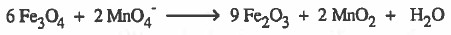
(6) نزن النقص في ذرات الهيدروجين بإضـافـة (H2O) عن كل ذرة هيدروجين ناقـصـة وفي الجهة الأخرى يضاف أيون ( -OH) عن كل جزيء ماء تمت إضافته.
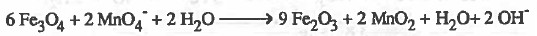
(7) نختصر المتكرر في المواد المتفاعلة والناتجة.

يمكن حل المثال السابق بدون كتابة الخطوات النظرية كما يلي: