جهد القطب القياسي
Standerd Electrode Potentials
تعريف جهد القطب القياسي Eo:
- هو مقياس القابلية مادة المصعد للتأكسد أو مادة المهبط للاختزال عند الظروف القياسية.
- ملاحظة : يعتبر الجهد قياسياً ويرمز له بـ Eo حينما يقاس عند الظروف القياسية:
- تركيز المحلول = 1molar
- درجة الحرارة = 25Co
- الضغط للغازات = 1atm
- من المعلوم أنه لا يمكن قياس قيمة جهد القطب للمادة مباشرة ولكن يمكن قياس فرق الجهد الناتج بين القطبين المكونين للخلية.
- ولمعرفة جهد القطب للمادة يجب أن توصل بمادة أخرى جهدها يساوي صفراً ، لذلك تم اختيار قطب الهيدروجين قطباً مرجعياً ، وتم الاتفاق على أن يكون جهده عند جميع الدرجات يساوي صفراً.
قطب الهيدروجين Hydrogen Electrode
- هو عبارة عن أنبوب زجاجي يحتوي على غاز الهيدروجين تحت ضغط جوي واحد ودرجة حرارة 25Co
- يتوسط هذا الانبوب صفيحة بلاتين يقوم بعمل الحفاز موصلة بسلك بلاتيني ، حيث يغمر هذا الأنبوب داخل محلول يحتوي على أيونات الهيدروجين مثل محلول حمض الكلور HCl الذي تركيزه ( 1molar) .
- ويمرر غاز الهيدروجين تحت ضغط جوي (1atm)
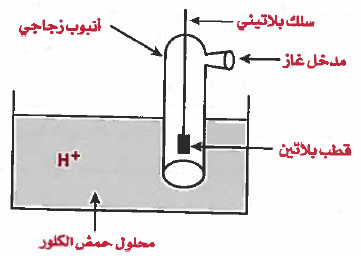
وقد تم الاتفاق على أن جهد الاختزال القياسي لقطب الهيدروجين (H2) يساوي صفر.
دلالة قيمة جهد القطب القياسي
(1) كلما زادت قيمة جهد الاختزال (Reduction Potential) للقطب تزداد قدرة مادة القطب على الاختزال، أي تزداد قدرته كعامل مؤكسد (تؤكسد العناصر الأقل منها).
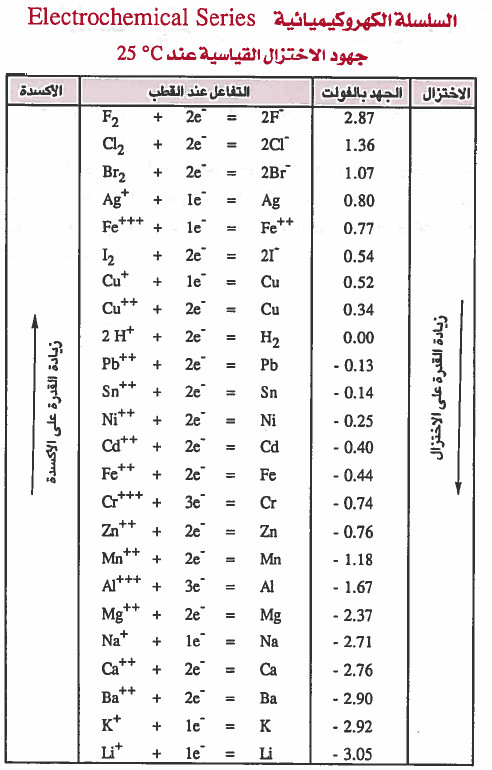
ومن الجدول أقوى العوامل المؤكسدة هي التي تقع على يسار العلامة (=) وفي الأعلى ولذلك فأقوى العوامل المؤكسدة (أسهل العناصر اختزالاً) هو الفلور F2.
كلما زادت قيمة جهد الاختزال تزداد قوة المادة كعامل مؤكسد.
(2) كلما نقصت قيمة جهد الاختزال للقطب تزداد قدرة مادة القطب على التأكسد أي تزداد قوته كعامل مختزل
من الجدول أقوى العوامل المختزلة هي التي تقع على يمين العلامة ( =) وفي الأسفل، ولذلك فأقوى العوامل المختزلة ( أسهل العناصر أكسدة ) في الجدول أعلاه هو الليثيوم Li.
كلما قلت قيمة جهد الاختزال تزداد قوة المادة كعامل مختزل .
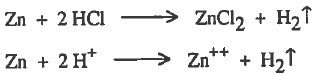
(3) إذا كانت قيمة جهد الاختزال للقطب بالموجب (Eo > zero) فإنه يصبح سهل الاختزال وصعب التأكسد ولذلك يصبح أقل نشاطاً من الهيدروجين. أي لا يستطيع أن يحل محل الهيدروجين في مركباته مثل الماء والأحماض في الظروف العادية.
توضيح: إذا كانت قيمة جهد الاختزال للقطب بالموجب (Eo > صفر) فإنه يصبح أقل نشاطاً من الهيدروجين ، أي لا يستطيع أن يحل محل الهيدروجين في مركباته مثل الماء والأحماض في الظروف العادية . فمثلاً النحاس لا يطرد الهيدروجين من أملاحه لان جهد اختزاله بالموجب ( Eo > صفر) :
لا يحدث تفاعل → Cu + HCl
لا يحدث تفاعل → +Cu + H
(4) إذا كانت قيمة جهد الاختزال للقطب بالسالب (Eo < صفر) فإنه يصبح أكثر نشاطاً من الهيدروجين .
أي يستطيع أن يحل محل الهيدروجين في مركباته مثل الماء والأحماض في الظروف العادية .
توضيح: إذا كانت قيمة جهد الاختزال للقطب بالسالب (Eo < صفر) فإنه يصبح أكثر نشاطاً من الهيدروجين .
أي يستطيع أن يحل محل الهيدروجين في مركباته مثل الماء والأحماض في الظروف العادية . فمثلاً الخارصين يطرد الهيدروجين من الحمض لأن جهد اختزاله بالسالب (Eo < صفر)
(5) إذا ضربت المعادلة في معامل ما فإن جهد الاختزال لا يتغير.
توضيح:

(6) يختلف جهد الاختزال عن جهد الاكسدة في الإشارة فقط ، كما يلي:
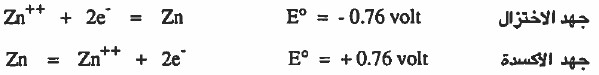
أسئلة محلولة على جهد الخلية القياسي
(1) علل: النحاس لا يحل محل هيدروجين الماء أو هيدروجين الأحماض المخففة ، بينما يحل الصوديوم محل هيدروجين الماء والأحماض المخففة
السبب: جهد الاختزال للنحاس أكبر من جهد الاختزال للهيدروجين ، أي أنه أقل نشاطاً من الهيدروجين لذلك لا يستطيع النحاس أن يحل محل الهيدروجين في الماء الحموض بعكس الصوديوم والذي له جهد اختزال اقل من الهيدروجين أي انه انشط منه لذلك يحل الصوديوم محل الهيدروجين في الماء أو الحموض.
(2) علل: المغنيسيوم يحل محل الحديد في محاليل املاحه ، بينما لا تحل الفضة محل الحديد في محاليل أملاحه.
السبب: المغنيسيوم أقل جهد اختزال من الحديد أي أنه انشط كيميائياً ، لذلك يمكن أن يحل محله في محاليل أملاحه ، بينما الفضة أعلى جهد اختزال من الحديد أي أنه اقل نشاطاً من الحديد لذلك لا يمكن أن يحل محل الحديد في محاليل أملاحه.
ملاحظة إضافية: المغنيسيوم له جهد اختزال سالب أكبر ، أي أن له أقل قابلية للاختزال وأكثر قابلية للأكسدة، بينما الفضة لها قابلية للاختزال أكبر . والحديد له قابلية للأكسدة أكبر.
(3) علل: النحاس يسبق الهيدروجين في السلسلة الكهروكيميائية بينما الخارصين يلي الهيدروجين في السلسلة الكهروكيميائية.
السبب: لان جهد اختزال الخارصين أقل من جهد اختزال الهيدروجين، بينما جهد اختزال النحاس أعلى من جهد اختزال الهيدروجين و ناصر مرتبة ترتيباً تنازلياً حسب قيم جهود اختزالها.