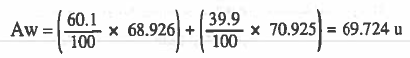الوزن الذري (Aw) Atomic Weight
من المعلوم أن الذرات صغيرة جداً جداً ، فعلى سبيل المثال وزن ذرة الهيدروجين (H) يساوي 24-10 × 1.67 جرام ، ووزن ذرة الأكسجين 23-10 × 2.66 جرام ، وبذلك فإن التعامل مع هذه الأرقام الصغيرة جـدأ أمر في غاية الصـعـوية ، ولذلك فمن المناسب هو أن تقارن أوزان الذرات مع بعضها البعض ، وقد نتج عن هذه المقارنة أوزان نسبية للذرات ، فمثلاً الأوزان النسبية الذرية للذرات: H , C , O هي على التوالي ( 16, 12, 1 ) وقد وضع لهـا وحـدة تسمى وحدة الكتلة الذرية (atomic mass unit) ويرمز لها اختصاراً (amu) فمثلاً:
الوزن الذري (الكتلة الذرية) للهيدروجين (H) هي: 1 amu
الوزن الذري (الكتلة الذرية) للأكسجين هي: amu 16
ملاحظة: لقد وجد أن وحدة الوزن النري تتناسب مع الأوزان الفعلية للذرات وأن وحدة الوزن الذري (amu) تساوي:
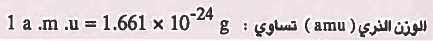
تعريف الوزن الذري هو معدل كتلة ذرات العنصر بالنسبة لكتلة ذرة الكربون 6C12 والتي حددت بـ 12 وحدة كتل ذرية (amu) او تختصر بـ (u).
ملاحظة : المقصود بـ (معـدل كتلة ذرات العنصر ) هو: معدل كتلة مخلوط النظائر التي يتألف منها العنصر.

ملاحظات هامة
نظراً لإختلاف بعض الكتب الكيميائية في كتابة مصطلح الوزن لبعض الكتب يطلق عليه الكتلة لذلك سوف نتفق على أن:
- الوزن الذري = الكتلة الذرية
- الوزن الجزيئي = الكتلة الجزيئية
- وزن مول واحد = كتلة مول واحد
- وحدة الوزن الذري (الكتلة الذرية) هي: (u)
- وحدة الوزن الجزيئي (الكتلة الجزيئية) هي: (u)
- وحدة وزن مول واحد (كتلة مول واحد ) هي: g . mol-1
مسائل محلولة على الوزن الذري
مثال (1): ذرات الكلور توجد في الطبيعة كما يلي : کلور 35C1 يوجد بنسبة % 75.4 ، کلور 37Cl يوجد بنسبة % 24.6، فما الكتلة الذرية (Aw ) للكلور؟
الحل:
من قانون حساب الوزن الذري فى حالة النظائر الذى ذكر أعلاه يكون:
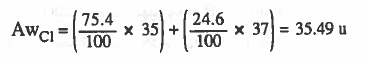
مثال (2): احسب متوسط الوزن الذري لعنصر يتكون من ذرات كتلتها u 68.926 ووفرتها في الطبيعة % 60.1 ، ونرات كتلتها u 70.925 بوفرة مقدارها % 39.9
الحل: