التحليل الكهربي Elctrolysis
- عندما يمر تيار كهربي خلال مركب أيوني مصهور أو محلول يحتوي على أيونات فإن تفاعلاً كيميائياً يحدث حيث تتحلل المادة كهربياً وهذا التفاعل يسمى التحليل الكهربي.
- وهذا التفاعل هو عبارة عن تفاعل أكسدة واختزال ويحدث داخل جهاز يسمى خلية التحليل الكهربي.
تعريف التحليل الكهربي
- هو عملية يحدث بها تفاعل كيميائي نتيجة مرور تيار كهربي أو هي تحول الطاقة الكهربائية إلى طاقة كيميائية.
هل يمكن حدوث التفاعل التالي:
2HI (aq) = I2 (s) + H2 (g)
- ويمكن كتابة المعادلة بالشكل التالي:
2I- (aq) + 2H+ (aq) = I2 (s) + H2 (g)
- يمكن الإجابة على السؤال وذلك من خلال حساب قيمة فرق الجهد الناتج عن هذا التفاعل:
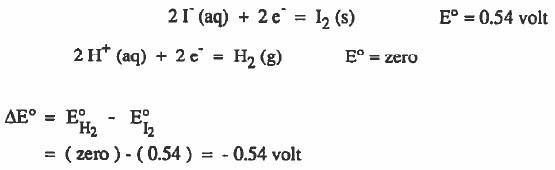
- نلاحظ أن فرق الجهد الناتج بالسالب . أي لا يمكن حدوث التفاعل كما هو مكتوب.
- ولكن يمكن أن نجبر هذه المواد على التفاعل إذا وفرنا لها الطاقة المناسبة أي تيار كهربي مناسب . وذلك من خلال خلايا التحليل الكهربي.
كيفية عمل خلية التحليل الكهربي (كيف نحصل على تفاعل تلقائي):
خطوات العمل:
(1) ضع محلول من يوديد الهيدروجين (HI) في كأس.
(2) نغمس قطبين من الكربون في المحلول.
(3) نوصل القطبين باسلاك بمصدر للتيار الكهربي فرق جهده أكبر من ( volt 0.54 ) كما في الرسم.
(4) نوصل البطارية (مصدر لتيار خارجي) والهدف منها هو ضخ الإلكترونات.
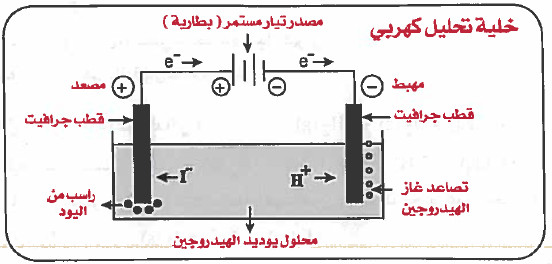
المشاهدة والاستنتاج:
(1) يسري التيار الكهربي (الإلكترونات) إلى القطب السالب (المهبط).
(2) تنجذب الأيونات الموجبة (+H) للقطب السالب لتكتسب الإلكترونات وتتحول إلى جزيئات غازية (H2) تتصاعد على شكل فقاعات عند المهبط حسب المعادلة:
2H+ (aq) + 2e- → H2 (g)
(3) تنجذب الأيونات السالبة (-I) للقطب الموجب لتفقد الإلكترونات وتتحول إلى جزيئات صلبة (I2) تترسب عند المصعد حسب المعادلة:
-2I- (aq) → I2 (s) + 2e
(4) تنتقل الإلكترونات عبر المصعد باتجاه مصدر التيار وهكذا.
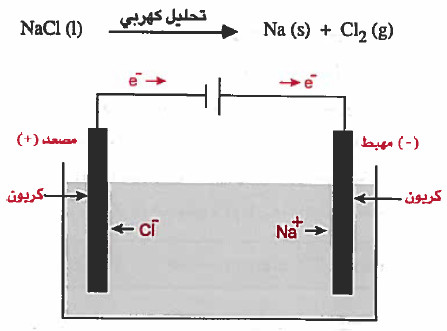
التحليل الكهربي لمصهور كلوريد الصوديوم (NaCl)
- عند صهر كلوريد الصوديوم يتفكك إلى أيونات موجبة +Na وايونات سالبة -Cl حرة الحركة.
- وعند إمرار تيار كهربي تنجذب أيونات الصوديوم الموجبة نحو المهبط (القطب السالب) وتتحول إلى ذرات الصوديوم (تختزل).
عند المهبط:
Na+ (l) + 1e- = Na (s)
أما أيونات الكلور السالبة فتنجذب نحو المصعد ( القطب الموجب ) لتختزل حيث تتحول إلى ذرات ، وكل ذرتين تتحدان لتكون جزيء كلور ليتصاعد عند المصعد على شكل غاز.
عند المصعد:
-2Cl- (l) = Cl2 (g) + 2e
وعند جمع نصفي التفاعل بعد التخلص من الإلكترونات:
سؤال: ماذا نلاحظ عند إمرار تيار كهربي في محلول كلوريد الصوديوم بين أقطاب الجرافيت.
جواب: يتصاعد غاز الكلور عند الأنود (المصعد)