الفعالية والتوجيه في مشتقات البنزين
- سبق وأن درسنا تفاعلات الاستبدال الالكتروفيلية لحلقة البنزين حيث يتم إدخال مجموعة بديلة واحدة على الحلقة وتنتج مشتقات البنزين الأحادية.
- ودون أدنى شك فإن حلقة البنزين في هذه المشتقات الأحادية تخضع لتفاعلات الاستبدال الالكتروفيلية الأروماتية.
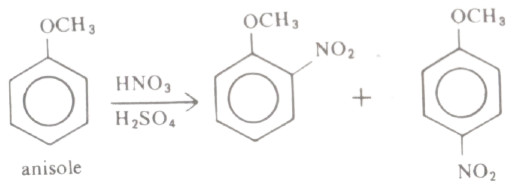
- فمثلاً يمكن نترتة الأنيزول باستعمال خليط من حمض الكبريتيك والنيتريك المركزين ويتكون خليط من مركبي أرثو وبارا نيترو أنيزول. كما أن نترتة الأنيزول تتم بصورة أسرع من نترتة البنزين نفسه.
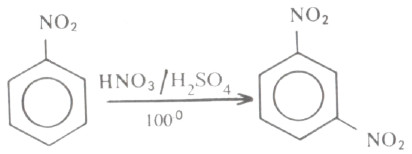
- ومن ناحية أخرى نجد أن مركب نيترويازين يتفاعل مع حمضي الكبريتيك والنتريك المركزين ويتكون مشتق ميتا. كما أن نترتة مركب نيتروبنزين تتم بصورة أبطأ من نترتة حلقة البنزين.
- يتضح لنا من المثالين السابقين أنه عند مهاجمة الكواشف الالكتروفيلية لحلقة البنزين فإن المجموعة المرتبطة بحلقة البنزين ليست المسئولة فحسب عن سرعة التفاعل ولكنها تحدد أيضاً الموقع الذي يقع عليه استبدال المجموعة البديلة الجديدة.
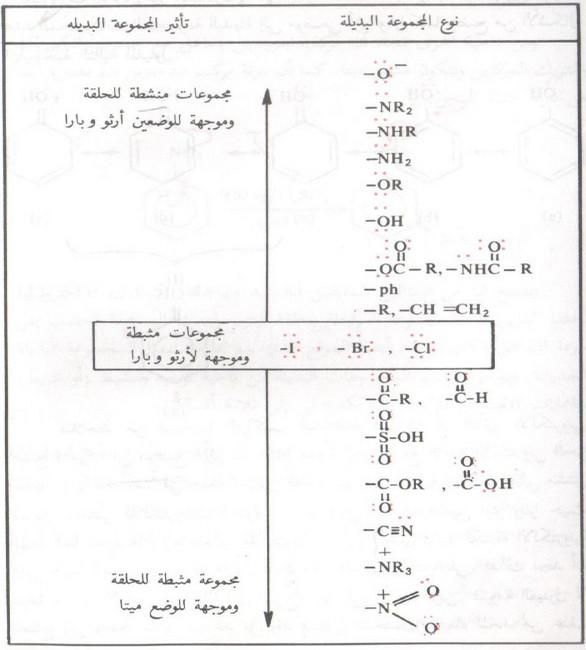
- ويمكن تقسيم المجموعات البديلة من ناحية توجيه وتنشيط (أو تثبيط) تفاعلات الاستبدال الأروماتي الالكتروفيلي إلى ثلاثة أقسام:
(1) مجموعات منشطة وتعمل على توجيه المجموعة الالكتروفيلية الجديدة إلى الموضعين أرثو وبارا مثل مجموعة OH- ، ومجموعة NH2- وهناك الكثير من المجموعات التي تسلك هذا السلوك كما بالجدول التالي
(2) مجموعات مثبطة وتعمل على توجيه المجموعة الالكتروفيلية إلى الموضع ميتا مثل مجموعة نيترو (انظر الجدول)
(3) الهالوجينات وهي مثبطة للحلقة الأروماتية ولكنها توجه المجموعة البديلة إلى موضعي أرثو وبارا.
الجدول التالي يوضح أهم المجموعات البديلة على الحلقة الأروماتية وترتيبها وفقاً لتأثيرها في نقصان الكثافة الإلكترونية على الحلقة .
تفسير ظاهرة الفعالية والتوجيه في مشتقات البنزين
- ويمكن تفسير ظاهرة الفعالية والتوجيه في مشتقات البنزين بالنظر إلى طبيعة المجموعة البديلة المتصلة بحلقة البنزين فيما لو كانت تزيد أو تقلل الكثافة الالكترونية على الحلقة سواء بالتأثير التأرجحي أو بالتأثير التحريضي.
أولاً/ المجموعات المنشطة التي تعمل على توجيه المجموعة الالكتروفيلية الجديدة إلى الموضعين أرثو وبارا
- فالمجموعات التي تعطي الكترونات عن طريق التأثير التأرجحي تحوي زوجاً أو أكثر من الالكترونات الحرة (غير المشاركة) على الذرة المتصلة مباشرة بحلقة البنزين، وتوجه هذه المجموعات المجموعة البديلة إلى موضعي أرثو وبارا كما يتضح من الأشكال التأرجحية التالية للفينول:
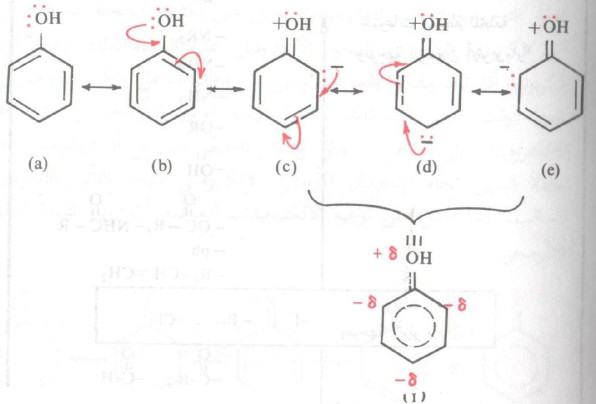
- فنلاحظ من مساهمة التراكيب المختلفة السابقة أن التأثير الالكتروني أصبح متمركزاً في مواضع الأرثو - والبارا نتيجة التأرجح مع الزوج الالكتروني الحر للبديل الموجود أصلاً في حلقة البنزين.
- فعندما يهاجم الكاشف الالكتروفيلي مشتق البنزين المعطى للالكترونات فسيوجه الالكتروفيل إلى الموضعين أرثو وبارا حيث أنهما هما الموضعان المتخمان بالالكترونات.
- كما تؤدى زيادة الكثافة الالكترونية على حلقة البنزين إلى سرعة معدل تفاعل الاستبدال الالكتروفيلي. لذلك نجد أن سرعة معدل الاستبدال في الفينول أسرع منها في حالة البنزين.
- فبرومة الفينول لا تحتاج إلى وجود عامل مساعد بل وقد يستلزم التخفيف بالماء للحد من عنف التفاعل ويتم الاستبدال بسهولة نظراً للكثافة الالكترونية العالية على الحلقة.
- هناك مجاميع أخرى تتصرف مثل مجموعة هيدروكسيل الفينول في كونها مانحة للالكترونات وتوجه الالكتروفيلات إلى موضعى الأرثو والبارا ويتم فيها الاستبدال بمعدل أسرع مما هو في حالة البنزين نفسه وتختلف هذه المجاميع في تأثيرها لقوة التوجيه باختلاف طبيعتها مثل مجموعة الأيثر والأمين.
ثانياً / المجموعات المثبطة التي تعمل على توجيه المجموعة الالكتروفيلية الجديدة إلى الموضعين أرثو وبارا
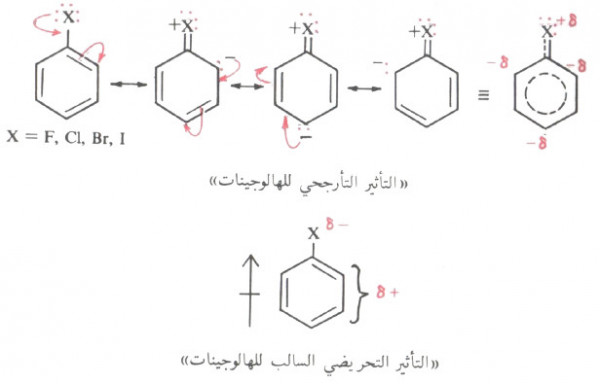
- الهالوجينات فهي توجه أيضاً للمواضع أرثو وبارا ولكن سرعة التفاعل الالكتروفيلي أقل مما هى فى البنزين أي تعمل على تثبيط حلقة البنزين.
- وسبب ذلك أن الهالوجينات تعمل على جذب الالكترونات خارج حلقة البنزين نتيجة للسالبية الكهربية العالية للهالوجينات وهذا ما يعرف بالفعل التحريضي السالب.
- نجد أن الفعل التحريضي السالب للهالوجينات يعمل على تكثيف الشحنة الموجبة على أيون الكربونيوم الناتج من الهجوم الالكتروفيلي على الحلقة لذلك يجعل أيون الكربونيوم أقل ثباتاً وبالتالي يعمل الهالوجين على إبطاء التفاعل.
- ولكن الهالوجين في نفس الوقت يعطي الكترونات للحلقة نتيجة التأثير التأرجحي وبذلك يوجه الالكتروفيلات إلى المواقع أرثو وبارا.
- ويمكن تلخيص ذلك في أن الهالوجين يثبط حلقة البنزين تجاه الإستبدال الأروماتي الالكتروفيلي نتيجة التأثير التحريضي السالب كما يعمل على توجيه الالكتروفيلات للموضع أرثو وبارا نتيجة التأثير التأرجحي.
- أما بالنسبة لمجموعة الميثل أو أي مجموعة ألكيلية أخرى متصلة بالحلقة فهي كما نعرف تنشط حلقة البنزين تجاه الإستبدال الأروماتي الالكتروفيلي وتوجه الالكتروفيلات إلى الموقع أرثو وبارا نتيجة التأثير التحريضي الموجب للمجموعة الألكيلية، حيث أنها تعطي الكترونات للحلقة.
- كما أن هناك نوعاً آخر من التأرجح يسمى فوق الازدواج Hyperconjugation والذي لن نتحدث عنه هنا ولكن دعنا نكتفي بالقول أنه يكثف السحابة الالكترونية على الموقع أرثو وبارا، وبالتالي يتم توجيه الالكتروفيلات إلى تلك المواضع.
- كما يمكن تفسير سرعة وتوجيه التفاعل الأروماتي الالكتروفيلي على مشتقات البنزين بطريقة أخرى حيث تقارن بين أيون الكربونيوم المتكون عند مهاجمة الموضعين بارا وأرثو أو الموضع ميتا في تلك المشتقات.
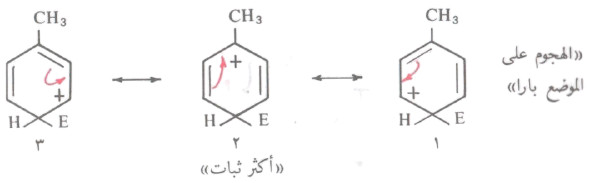
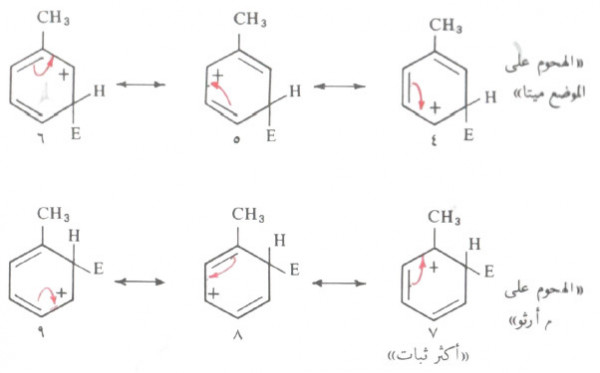
- فمثلاً في حالة التولوئين، نجد أن الهجوم على الموضع بارا يمكن تمثيله بالهجين للتراكيب من وبالنسبة للموضع ميتا هجين للتراكيب من (٤ ٦).
- أما في حالة موضع الأرثو يمكن التمثيل عنه بالهجين للتراكيب من (٧ - ٩) كما في حالة البارا.
- نجد أن التركيبين (٢ ، ٧) هما اللذان توجد بهما شحنة موجبة على ذرة الكربون التي تحمل مجموعة الميثل.
- وبالرغم من أن مجموعة الميثل (CH3) تمنح الالكترونات إلى جميع المواضع الحلقة إلا أنها تعمل على منح الالكترونات بكمية أكبر إلى ذرة الكربون المجاورة. وبالتالي يكون التركيبان (٢، ٧) أكثر ثباتاً من التراكيب التأرجحيه الأخرى.
- لذلك يمكن القول أن هجين أيون الكربونيوم الناتج من الهجوم على الموضع بارا وأرثو يكون أثبت من أيون الكربونيوم الناتج عن الهجوم على الموضع ميتا. ونتيجة لذلك فإن الإستبدال في المواضع بارا وأرثو يكون أسرع من الإستبدال في الموضع ميتا.