أشكال الرنين Resonance Structures
- يمكن باستخدام مجموعة الذرات نفسها الحصول على أكثر من تركيب لويس صحيح، وذلك حينما يكون للجزيء أو الأيون المتعدد الذرات روابط أحادية وثنائية في الوقت نفسه.
- الرنين حالة تحدث عندما يكون هناك احتمال لرسم أكثر من تركيب لويس لشكل الجزيء أو الأيون.
- يشار إلى تركيب لويس الصحيح الذي يمثل الجزئ نفسة أو الأيون بأشكال الرنين.
- تختلف أشكال الرنين في مكان وجود أزواج الألكترونات لا في مكان وجود الذرة ، لذا تختلف أماكن الأزواج غير الرابطة وأزواج الروابط في الأشكال.
- لجزئ O3 والأيونات المتعددة الذرات -CO32- ، SO32- ، NO2 أشكال رنين.
- ومن المهم معرفة أن كل جزيء أو أيون له رنين خاص به، يظهر كأن له بناءً واحداً فقط.
- مثال: لأيون النترات المتعدد الذرات المبين في الشكل التالي ثلاث أشكال متكافئة يمكن استعمالها لتمثيل هذا الأيون.

الشكل (a): تختلف اشكال الرنين هذة في مكان الرابطة الثنائية فقط ، ولا تتغير أماكن ذرات النيتروجين والأكسجين
الشكل (b): يكون أيون النترات الحقيقي هو متوسط أشكال الرنين الثلاثة في (a)
- تبين الخطوط المنقطة أماكن محتملة للرابطة الثنائية.
- أظهرت القياسات العملية أن أطوال الروابط لهذا الجزيء المحسوبة فى المختبر متماثلة، وتكون الروابط أقصر من الروابط الأحادية، ولكنها أطول من الروابط الثنائية.
بعض قواعد الرنين
(1) إن بناءات الرنين ليس لها وجود فعلي لكنها تستخدم لتساعد في وصف الجزئ أو الأيون الذي لا يمثله بناء واحد للويس.
(2) عند كتابة بناءات الرنين يجب تغيير مواقع الإلكترونات فقط دون تغيير مواقع الأنوية .
(3) يجب أن يكون في كل بناء رنيني نفس العدد من الإلكترونات المفردة .
(4) كلما زاد عدد الروابط التساهمية في بناء الرنين كلما كان أكثر ثباتا .
(5) عندما تكون الشحنات على بناء الرنين منفصلة فأن الثبات يقل .
(6) البناء الذي تكون فيه الشحنة السالبة على ذرة أعلى كهروسالبية يكون أكثر ثباتا .
(7) البناء الذي تكون فيه لكل ذرة تركيب الغاز الخامل يكون الأكثر ثباتا .
(8) الطول الحقيقي للرابطة هو المتوسط الحسابي لأطوال الروابط في أشكال الرنين.
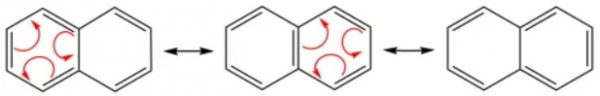
(1) الرنين فى النفثالين Resonance in naphthalene
- عدد الأشكال الرنينية التى يمكن وجودها فى النفثالين= 3
- توضح الأشكال التالية حدوث الرنين فى مركب النفثالين.
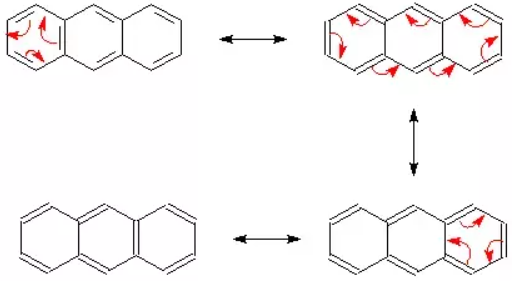
(2) الرنين فى الأنثراسين Resonance in anthracene
- عدد الأشكال الرنينية التى يمكن وجودها فى الانثراسين = 4
- توضح الأشكال التالية حدوث الرنين فى مركب الأنثراسين.
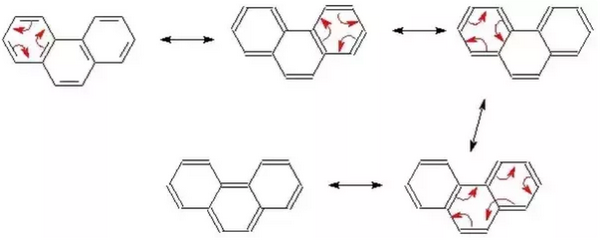
(3) الرنين فى الفينانثرين Resonance in Phenanthrene
- عدد الأشكال الرنينية التى يمكن وجودها فى الفينانثرين = 5
- توضح الأشكال التالية حدوث الرنين فى مركب الفينانثرين:
مقارنة بين أشكال الرنين فى المركبات الثلاثة
- الشكل التالي يوضح مقارنة بسيطة بين أشكال الرنين فى المركبات الثلاثة
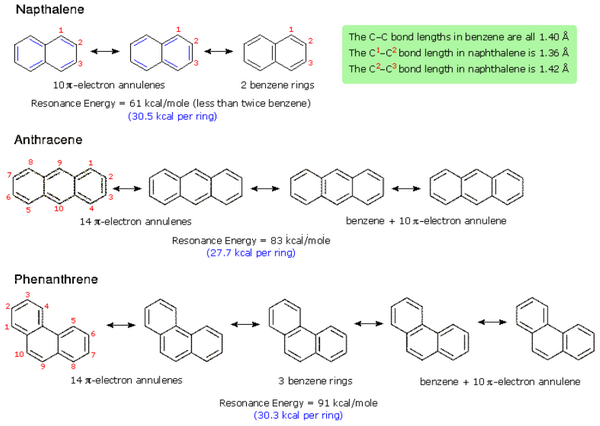
- طاقة الرنين لحلقة البنزين الواحدة فى مركب = طاقة الرنين الكلية للمركب / عدد حلقات البنزين الموجودة به
- طاقة الرنين لحلقة البنزين الواحدة فى البنزين = 36/1 = 36 kcal/mole
- طاقة الرنين لحلقة البنزين الواحدة فى النفثالين = 61/2 = 30.5 kcal/mole
- طاقة الرنين لحلقة البنزين الواحدة فى الأنثراسين = 83/2 = 27.7 kcal/mole
- طاقة الرنين لحلقة البنزين الواحدة فى النفثالين = 91/2 = 30.3 kcal/mole
- كلما كانت طاقة الرنين resonance energy لحلقة البنزين الواحدة أكبر كلما كان المركب أكثر ثباتاُ ، لذلك نجد أن المركبات تترتب حسب الأكثر ثباتاُ كالتالي:
benzene > naphthalene > anthracene > Phenanthrene
- المركب الأقل ثباتاُ هو المركب الأكثرنشاطاُ تجاه التفاعلات more reactive لذلك نجد أن المركبات تترتب حسب الأكثر نشاطاُ كالتالي:
Phenanthrene > anthracene > naphthalene > benzene