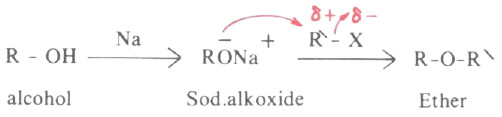تحضير الايثرات من الكحولات
- تنشأ الايثرات من إزالة أو انتزاع جزىء ماء من جزيئين من الكحول.
- ويتم ذلك بوجود الحمض (يستخدم في العادة حمض الكبريتيك) وعند درجة حرارة عالية كما يتضح من المثال التالي:
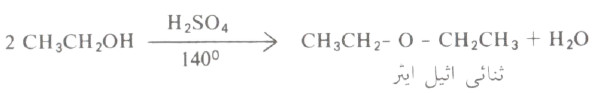
- ويجري هذا التفاعل باستخدام أقل من مكافيء من الحمض المعدني (H2SO4)، وهذا يعني أن جزءاً فقط من الكحول هو الذي يتحول إلى أيون الأوكسونيوم في حين يمثل الجزء الآخر من الكحول كاشفاً نيكلوفيلياً يستبدل جزىء الماء من أيون الأوكسونيوم كي ينتج الحمض المرافق للايثر الذي بدوره هو الأخير قادر على إعطاء بروتون كي ينتج الايثر الحر كما يتضح من المعادلة العامة التالية:
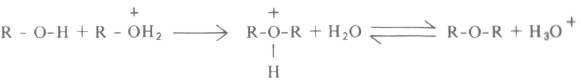
- سبق وأن رأينا أن الكحولات في وجود حمض الكبريتيك يمكن أن تتحول إلى أوليفينات، وهنا اتضح لنا أن الايثرات يمكن أن تتكون أيضاً من الكحولات في وجود حمض الكبريتيك (نفس التفاعل).
- وعلينا أن ندرك الفارق في ظروف التجربتين:
(1) في تفاعل تكوين الأوليفين من الكحول يستخدم تركيز أعلى من الحمض، وفي هذه الظروف فإن الكحول يتحول كلية إلى أيون الأوكسونيوم فلم يعد هناك وجود للكحول الحر الذي يمثل كاشفاً نيكلوفيلياً في تفاعل تكوين الايثر.
(2) تفاعل تكوين الأوليفين يجري عند درجات حرارة أعلى نسبياً من درجات الحرارة في تفاعل تكوين الايثرات من الكحولات.
- يقتصر هذا التفاعل في المختبر على تحضير الايثرات المتماثلة (المتناظرة) تلك التي لها أوزان جزيئية منخفضة أي أنه يمكن تقطيرها من وسط التفاعل فهي الغالب ذات درجات غليان منخفضة مقارنة بدرجات غليان النواتج الأخرى.
- أما الأيثرات غير المتماثلة فلا يصح تحضيرها وفقاً لهذه الطريقة لأن استخدام كحولين مختلفين يؤدي إلى تكون خليط من أربعة مركبات ايثرية.
- وتحضر الايثرات غير المتماثلة في المختبر وفقاً لطريقة وليمسون حيث يحل أيون الكوكسيد محل الهاليد في هاليد الألكيل.