عدد المكافئات الجرامية
- حساب عدد المكافئات الجرامية (Eq) بقسمة وزن المادة بالجرام (m)على الوزن المكافئ (Ew) بالعلاقة التالية :
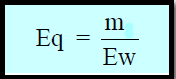
- حيث Ew : الوزن المكافئ للمادة المذابة ، والذي يمكن حسابه من العلاقة التالية:
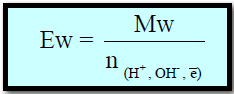
طرق حساب الوزن المكافئ Equivalent Weight
(1) في حالة الأحماض
الوزن المكافئ في هذه الحالة يصبح الوزن الجزيئي مقسوماُ علي عدد ذرات الهيدروجين البدول أي الموجودة في الحمض
Equivalent weight = Molecular weight / no. of Hydrogen
مثال: ما هوالوزن المكافي لحمض الكبريتيك المركز H2SO4 ؟
عدد ذرات الهيدروجين = 2
الوزن المكافي =الوزن الجزيئي /2 = (2×1 +32+16 ×4) /2 = 98 /2 = 49
(2) في حالة القواعد
في حالة اذا كان المركب قاعدة OH فالوزن المكافئ في هذه الحالة = الوزن الجزيئي للقاعدة مقسوماً علي عدد ذرات الهيدروكسيل البدول الموجودة فى القاعدة
Equivalent weight = Molecular weight / no. of hydroxyl group
مثال: ما هو الوزن المكافي لمركب هيدروكسيد الكالسيوم Ca(OH)2 ؟
عدد مجموعات الهيدروكسيل = 2
الوزن المكافي = الوزن الجزيئي للمركب / 2 = (40 + 17 × 2) / 2 = 37
(3) في حالة الأملاح
إذا كان المركب ملح فالوزن المكافي = الوزن الجزيئي مقسوماُ علي تكافؤ أحد الشقين في عدد تواجده فى المركب
Equivalent weight = Molecular weight / equivalent one of the two × no. of atom
مثال: ما هو الوزن المكافئ لمركب نترات الفضة AgNO3؟
- نترات الفضة هي مركب فيكون الوزن المكافي لها = مجموع الاوزان الذرية الداخلة في المركب / تكافؤ احد الشقين في عدد تواجده
- تكافؤ احد الشقين مثلا الفضة Ag =1 ، وعدد تواجده فى المركب = 1 فيتم القسمة علي واحد
او الشق الثاني هو النترات NO3 تكافؤ النترات أحادي ، وعدد تواجده فى المركب = 1 فيتم القسمة علي واحد ايضاً
- الوزن المكافي لمركب نترات الفضة AgNO3 يساوي (107.87 + 14.007 + 16×3) / 1 = 169.87
(4) فى حالات الأكسدة والأختزال
في حالة اذا كان المركب يخضع الي تفاعلات الاكسدة والاختزال فان الوزن المكافي = الوزن الجزيئي مقسوماُ علي عدد ارقام الاكسدة او الأختزال
Equivalent weight = Molecular weight / Number of oxidation or reduction
ويلزم لذلك معادلة الأكسدة والأختزال لإيجاد عدد الألكترونات المشاركة فى تفاعلات الأكسدة والأختزال.
حل السؤال: كيف يتم تحويل 10 مكافئ من 2(Ba(OH إلى جرام؟
أولاً/ نحسب الوزن الجزيئي لهيدروكسيد الباريوم Ba(OH)2
Mw = 137.33 + (16 + 1)*2
171.33gm/mol =
ثانياً: نحسب الوزن المكافئ لهيدروكسيد الباريوم
القانون التالي يستخدم فى حالة حساب الوزن المكافئ للقواعد
Equivalent weight = Molecular weight / no. of hydroxyl group
الوزن المكافي لمركب هيدروكسيد الكالسيوم Ba(OH)2 ؟
عدد مجموعات الهيدروكسيل = 2
الوزن المكافي = الوزن الجزيئي للمركب / 2 = 171.33 / 2 = 85.67
ومن القانون التالي
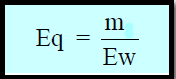
نجد أن:
؟؟ =Eq = 10 , Ew = 85.67 , m
وبالتعويض فى القانون السابق:
10 = m / 85.67
m = 856.75gm
الحل المباشر وباختصار
