تفاعلات الكحولات Reactions of alcohols
- تقوم الكحولات بتفاعلات تشتمل على:
(1) حمضية الكحولات
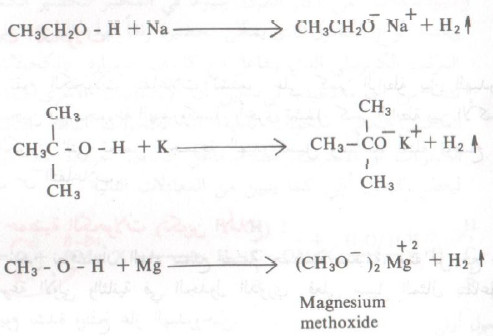
- تتفاعل الكحولات مع هذه معادن المجموعة الأولى والثانية في الجدول الدوري ومع عناصر معينة في المجموعة الثالثة أيضاً
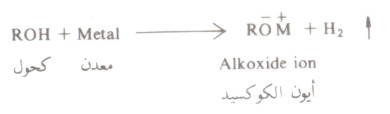
- وهذا التفاعل ما هو إلا تفاعل أكسدة واختزال حيث يتأكسد المعدن ( يفقد الكترونات ويكتسب شحنة موجبة) ويختزل البروتون إلى الهيدروجين:
2H+ + 2e- → H2
- ومن الأمثلة على تفاعلات الكحولات مع المعادن مايلي:
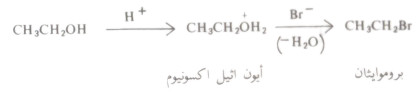
(2) تفاعل الكحولات مع هاليدات الهيدروجين
- تتفاعل الكحولات مع هاليدات الهيدروجين لتتكون هاليدات الألكيل.
- لهذا التفاعل أهميته في تحضير الهاليدات الألكيلية أي يتم في هذا التفاعل استبدال مجموعة الهيدروكسيل بذرة الهالوجين.
- ويحفز هذا التفاعل بالحمض ولا يسير بمعدل ملموس ما لم يوجد حمض قوي، قد يكون هاليد الحمض المستخدم أو قد يكون حمضاً قوياً مثل حمض الكبريتيك.
- ولايتم استبدال مجموعة الهيدروكسيل في الكحول نفسه لأن مثل هذا الاستبدال يتطلب استبدال أيون الهيدروكسيد وهو قاعدة قوية حيث أن القواعد الضعيفة في العادة هي التي تمثل مجموعات سهلة الإزاحة (مغادرة جيدة).
- فالكحول الثالثي يتفاعل مع حمض الهيدروكلوريك المخفف dilute HCl وعند درجة حرارة الغرفة إذ يتكون كلوريد الألكيل المطابق.
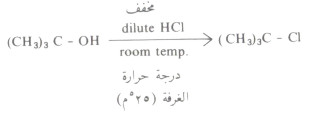
- أما كلوريد الألكيل الناشيء من الكحول الأولي فلا يتم إلا بالتسخين ومع حمض الهيدروكلوريك المركز HCl.
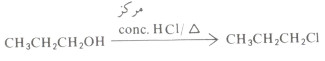
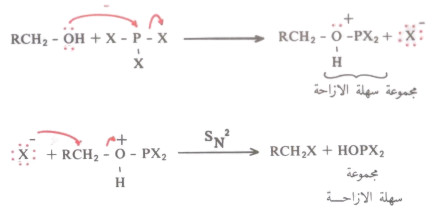
(3) تفاعل الكحولات مع PX3
3R - OH + PX3 → 3R - X + H3PO3
X = Br , I ) (R = 1o , 2o ))
- يتفاعل الكحول في الخطوة الأولى مع PX3 ليكون مجموعة مزاحة سهلة ومن ثم يتمكن أيون الهاليد من إزاحتها وبالتالي تكوين هاليد الألكيل.
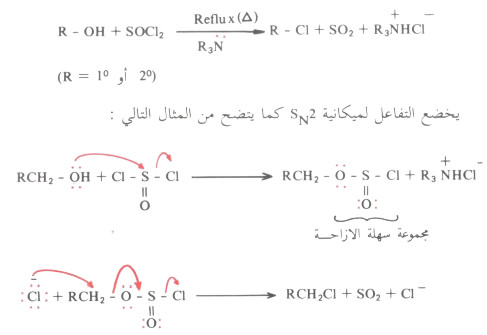
(4) تفاعل الكحولات مع SOCl2
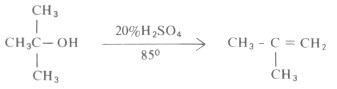
(5) انتزاع الماء من الكحول
- تخضع الكحولات إلى حادثة انتزاع جزىء الماء (Dehydration) لتتكون الأألكينات المطابقة ، وذلك عند درجات حرارة عالية وتركيز عال من الحمض.
- الأحماض المستخدمة في هذه التفاعلات مثل حمض الكبريتيك وحمض الفوسفوريك. هذا وقد تستخدم حموض لويس مثل أكسيد الألومنيوم.
- تترتب الكحولات من حيث سهولة فقد جزىء الماء على النحو التالي: الكحول الثالثي أسهل فقداً لجزئ الماء من الكحول الثانوي هو بدوره أسهل من الكحول الأولي.
- فالكحولات الأولية تحتاج لدرجة حرارة أعلى وتركيز حمضي أعلى:
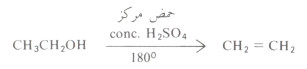
- أما الكحولات الثالثية فهي تفقد جزىء الماء بسهولة فمثلاً يكفي استخدام حمض كبريتيك تركيزه %۲۰% وعند درجة حرارة ٨٥م في حالة كحول بيوتيل الثالثي.