تفاعل تكاثف ألدول للألدهيدات والكيتونات؟
(1) تفاعل تكاثف ألدول للألدهيدات
- عندما يتفاعل الألدهيد الذي يحوى ذرة هيدروجين ألفا مع هیدروکسید الصوديوم المخفف في درجة حرارة الغرفة أو أقل فإنه يتضاعف ويعطي بيتا - هيدروكسي ألدهيد B - hydroxyaldehyde ، على سبيل المثال:
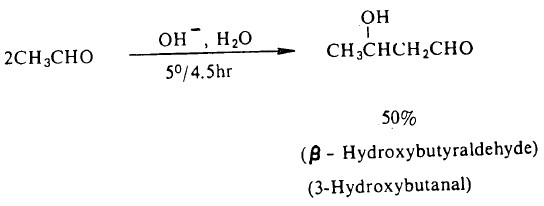
وهذا التفاعل عام لجميع الألدهيدات التي لها ذرة هيدروجين ألفا (C- CHO-) التي تتمتع بالصفة الحمضية كما أشرنا سابقاً ويعرف هذا التفاعل بتكثف الألدول.
- وقد استخدم له هذا الاسم (الدول aldol) لأن الناتج يحوي مجموعة الدهيدية (ald) ومجموعة كحولية (ol-) في نفس الوقت.
- هذا ويتم انتزاع جزىء الماء من ناتج الألدول ليتكون ألفا، بيتا ـ ألدهيد غير مشبع (α, β-unsaturated aldehyde) باستخدام تركيز أقوى من القاعدة أو في وجود حمض معدني مخفف وعند درجة حرارة مرتفعة نسبياً كما يتضح من المثال التالي:
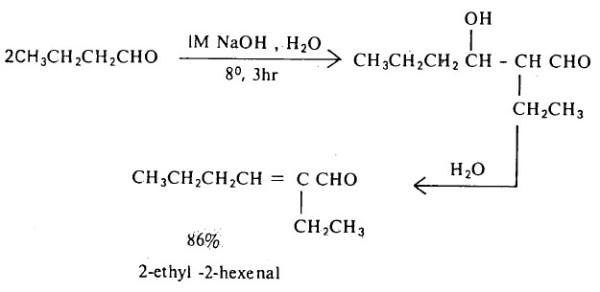
وقد يسير هذا التفاعل وفقاً لما توضحه المعادلات التالية:
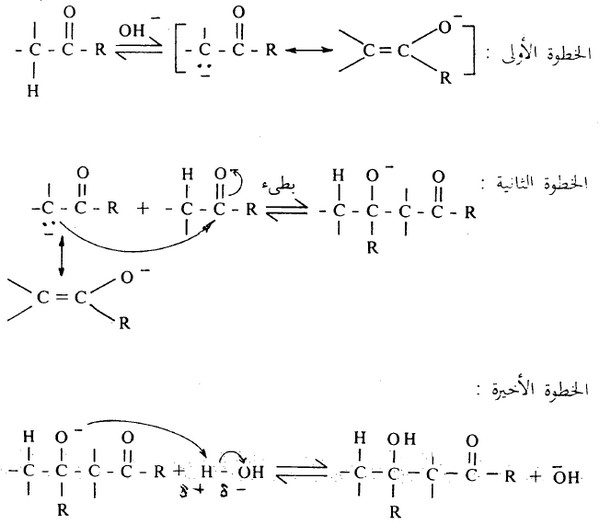
كما يبدو من المعادلات أعلاه أن هذا التفاعل ماهو إلا تفاعل إضافة نيكلوفيلي على ذرة كربون مجموعة الكربونيل (الخطوة الثانية)، حيث يؤدي دور النيكلوفيلي أيون الانولات الذي نشأ من انتزاع ذرة هيدروجين ألفا في جزىء الألدهيد (الخطوة الأولى).
- وفي الإنولات الخطوة الأخيرة فإن أيون الكوكسيد الناتج في الخطوة الثانية ينتزع بروتوناً من الماء ويتكون الألدول.
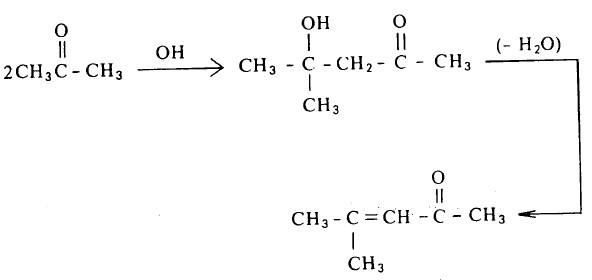
(2) تفاعل تكاثف ألدول للكيتونات
- وبالمثل فإن الكيتونات التي لها ذرات هيدروجينألفا تخضع لتكاثف الألدول تحت نفس الظروف السابقة، ويعلل ميكانكيية هذا التكثف بالنسبة للكيتونات وفقاً للنمط الذي يسير عليه تكثف الألدول من الألدهيدات.
(3) تفاعل تكاثف ألدول لألدهيدين مختلفين
- إذا ما عومل خليط من ألدهيدين مختلفين لكل منهما ذرة هيدروجين ألفا، فإنه من المتوقع أن نحصل على أربعة نواتج ألدول على الأقل.
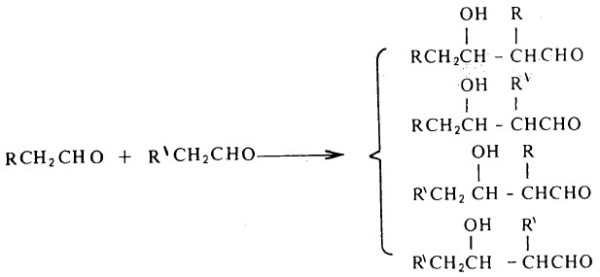
ويعرف هذا التفاعل، بتفاعل الألدول المتصالب Crossed aldol condensation وليس له قيمة في التحضيرات المخبرية لأنه يؤدي إلى خليط معقد من النواتج.
- ومع ذلك فإن هذا التفاعل يصبح ذا أهمية عملية إذا كان أحد الألدهيدين خالياً من ذرة هيدروجين ألفا أي أنه يعجز عن التكاثف مع نفسه، بمعنى آخر يعطي أيون الإنولات في الوسط القاعدي.
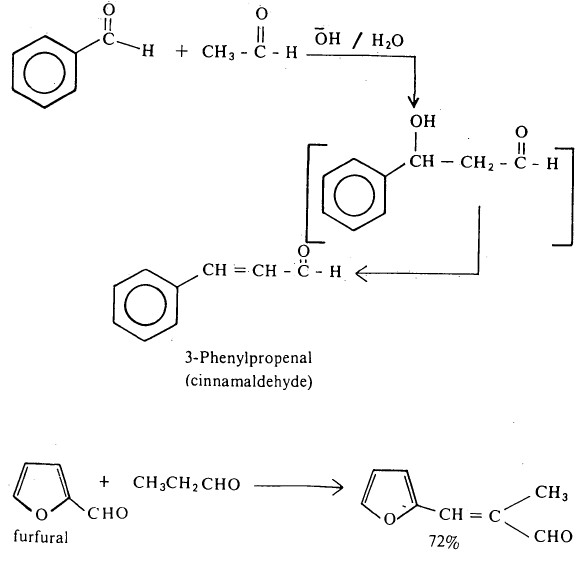
- وقد يحدث تفاعل الألدهيد المتصالب مع كيتون وألدهيد كلاهما له ذرة هيدروجين ألفا.
- ويعرف هذا التفاعل بتفاعل كليزن - شمیدت Claisen-Schmidt Condensation Reactions
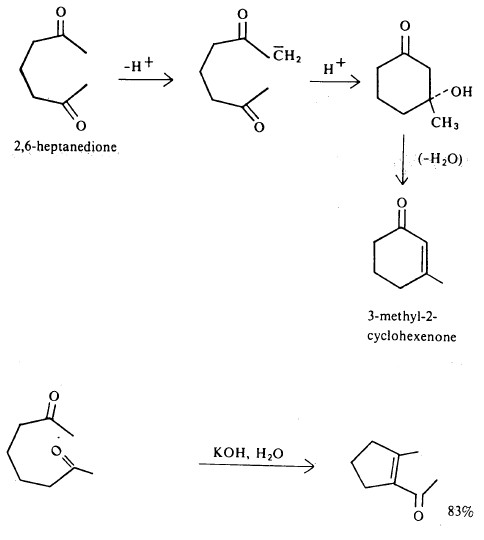
- لتفاعل تكاثف الدول أهمية في الاصطناع المخبري سواء لنواتج الألدول التى تتكون في الخطوة الأولى أو تلك المتكونة بعد انتزاع الماء كما يتضح من التحولات التالية :
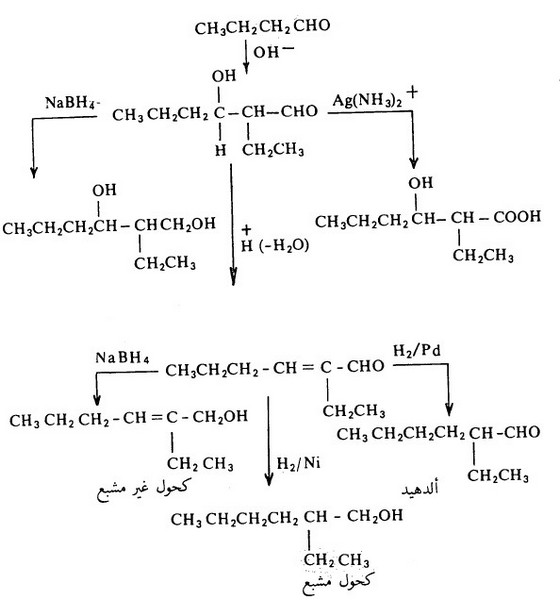
هذا ويمكن تكون نواتج حلقية من إضافة الألدول إذا ما توفر كل من العامل النيكلوفيلي ومجموعة الكربونيل في نفس الجزىء، على سبيل المثال: