قاعدية الأمينات (تكوين الأملاح)
- الأمينات الأروماتية وكذلك الأليفاتية تعتبر مركبات قاعدية لاحتوائها على ذرة النيتروجين التي تحمل زوجاً حراً من الالكترونات.
- وبالرغم من أنها قواعد ضعيفة مقارنة بهيدروكسيد الصوديوم مثلاً وهيدروكسيدات المعادن الأخرى، إلا أنها قواعد أقوى من الكحولات والماء.
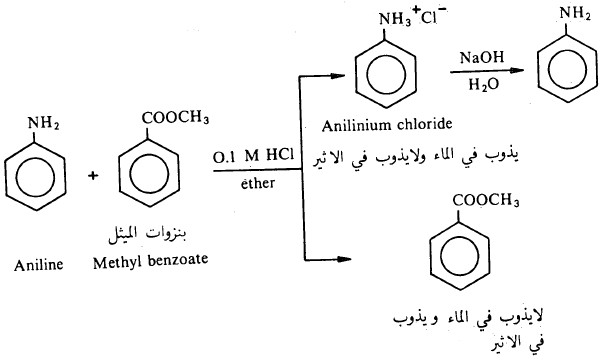
- حيث أن جميع الأمينات سواء الذي يذوب منها والذي لا يذوب في الماء، سوف تتفاعل مع الأحماض المعدنية لتعطي أملاحاً تذوب في الماء.
- هذه الخاصية تجعل من الممكن فصل الأمينات عن المركبات العضوية الأخرى القاعدية التي لا تذوب في الماء، وكمثال على ذلك فصل الأنيلين من بنزوات الميثيل.
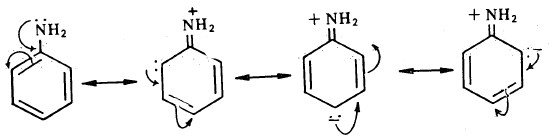
- تتصف الأمينات الأروماتية بالقاعدية الضعيفة مقارنة بالأمينات الأليفاتية والأمونيا، وذلك نتيجة لدخول الزوج الالكتروني الحر الموجود على النيتروجين في أوضاع تأرجحية مع الكترونات باى في حلقة البنزين، بينما يتعذر وجود مثل هذه الأشكال التأرجحية . حالة الأمينات الأليفاتية.
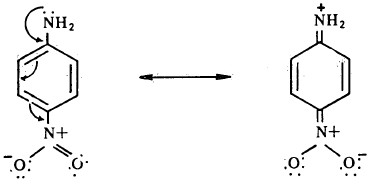
- كما أن وجود مجاميع ساحبة للالكترونات (مثل مجموعة النيترو) تعمل على تقليل قاعدية الأمين الأروماتي، لأن تلك المجاميع تعمل على زيادة كثافة الشحنة الموجبة على أيون الأنيلينيم.
- أما وجود مجاميع معطية للالكترونات فإنها تزيد من قاعدية الأمين الأروماتي لأن تلك المجاميع تعمل على تثبيت الشحنة الموجبة على أيون الأنيلينيم وبالتالي تزيد من أستقراره.
- أو بمعنى آخر فإن المجاميع المعطية للالكترونات تزيد من الكثافة الالكترونية على ذرة النيتروجين وهذا يزيد من قاعدية الأمين الأروماتي.
- كذلك الأمر بالنسبة للأمينات الأليفاتية فإنه نتيجة للتأثير التحريضي للمجاميع الألكيلية المتصلة بالنيتروجين فإن الأمينات الثالثية أعلى قاعدية من الثانوية وهذه بدورها أعلى من الأولية وذلك في الحالة الغازية.
- ولكن هذا الترتيب يختلف في المحلول المائي حيث أن الأمونيوم الناتج من الأمينات الثانوية والثالثية مثبت بجزيئات المذيب أكثر من أيون الأمونيوم الناتج من الأمينات الثالثية، لذلك الأمينات الثالثية أقل قاعدية في المحلول المائي من الأمينات الثانوية المطابقة.
ثابت قاعدية الأمينات
- يمكن التعبير عن قوة القاعدية بواسطة ثابت القاعدية (Equilibrium constant(Kb والذي يمكن حسابه من قانون فعل الكتلة بنفس طريقة حساب ثابت الحمضية (Ka) في حالة الأحماض حيث أن الأمين يعطي مع الماء محلولاً قاعدياً كما يلي:
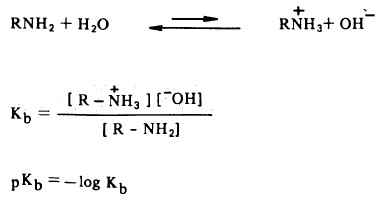
- وبالتالي كلما كان Kb كبيراً كلما كانت قاعدية الأمين قوية والعكس صحيح.
- أو كلما كان pkb كبيراً كلما كانت قاعدية الأمين ضعيفة والعكس صحيح.
- وذلك لأن pkb عبارة عن اللغاريتم السالب لثابت القاعدية .
- فمثلاً ثنائي ميثل أمين له ثابت قاعدية مساوى 5.1 × -104 وبالتالي فإن pKb يساوي 3.29 بينما تقل قاعدية الأنيلين عن قاعدية ثنائي ميثل أمين حيث أن له ثابت قاعدية يساوي 4.2 × -1010 وبالتالي فإن pKb يساوي 9.38