تعيين الوزن الجزيئي باستخدام معادلة فان درفالز
الجانب النظري
- يمكن كتابة معادلة الحالة لفان درفالز لمول واحد من غاز كما يلي:
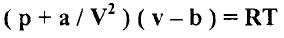
- حيث (a) و (b) ثابتان. ويعطي الحجم المولي (V) بالمعادلة التكعيبية التالية:
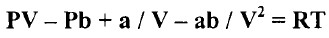
- ويمكن كتابة المعادلة بتعويض P/RT عن 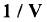 بالحد الثالث وإهمال الحد الصغير ab/V2.
بالحد الثالث وإهمال الحد الصغير ab/V2.
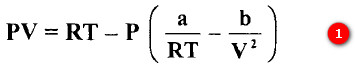
- فإذا علمت قيمتا الثابتين (a) و (b) يمكن حساب الحجم المولي لغاز عند درجة حرارة وضغط التجربة.
- يمكن تحديد الوزن الجرامي (W) لحجم معلوم من غاز النتروجين أو ثاني أكسيد الكربون. مثلاً، مقداره (V) لتراً تجريبياً.
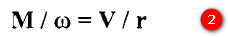
- لذا يمكن حساب الوزن الجزيئي M للغاز.
الأدوات والكيماويات
هذه الأدوات والكيمياويات اللازمة لتعيين الوزن الجزيئي باستخدام معادلة فان درفالز كما يلي:
- كرة زجاجية
- صندوق خشبي
- قارورة ذات فوهة واسعة
- سدادة مطاطية
- ثلاث حنفيات
- برج من جل السليكا
- حنفية زجاجية لها شكل (T)
- مانومتر زئبقي
- مضخة تفريغ أسطوانة من النتروجين أو غاز ثاني أكسيد الكربون
- ملاط .
الجانب العملي
- توزن الكرة الزجاجية بعد تفريغها من الهواء ثم تملأ بماء مقطر عند درجة الغليان.
- بعدها تغمس الكرة بحمام مائي ويتركان حتى يصلا إلى حالة اتزان حراري بحيث تكون حنفية الكرة مفتوحة.
- بعدها توزن الكرة الزجاجية وهي مملوءة بالماء.
- عندها يحسب حجم الكرة بمعلومية كثافة الماء بدرجة حرارة التجربة.
- تفرغ الكرة، وتنظف بخليط حمض الكروميك ثم تغسل بالماء، ثم تجفف باستخدام الكحول والأيثر، يشحم مفتاح الحنفية بشكل مناسب.
- بعدها تفرغ الكرة من الهواء وتوزن ثم تملأ الكرة بغاز النتروجين أو ثاني أكسيد الكربون بضغط أعلى قليلاً من الضغط الجوي.
- بعد ذلك تحفظ الكرة بالصندوق الخشبي أثناء ملئها بالغاز، وعند الوصول إلى الاتزان الحراري تفتح الحنفية ذات المسالك الثلاثة (الحنفية ذات الشكل (T) ويضبط ضغط الكرة بحيث يساوي الضغط الجوي المقروء من البارومتر . بعدها توزن الكرة ومحتوياتها.
- قيم ثابتي فان در فالز (b , a) لغازي النتروجين وثاني أكسيد الكربون كالتالي:

- تستخدم هذه القيم عندما يقاس الضغط بالجو atm والحجم باليترات . وقيمة ثابت الغازات R هي 0.08 لتر جو / مول . م
- باستخدام هذه القيم يمكننا حساب حجم مول واحد من غاز من المعادلة (1) عند درجة حرارة وضغط التجربة.
- يحسب الوزن الجزيئي للغاز من المعادلة (2).