(21) اتزان كيميائي Chemical Equilibrium
- هي حالة تكون فيها سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي.
- يعبر عادة عن التفاعل المتزن بأسهم متعاكسة.
- من الأمثلة على الأنظمة المتزنة الاتزان الآتي:
N2O4 ↔ 2NO2
(22) الصيغ الكيميائية Chemical Formula
- هي طريقة رمزية للتعبير عن تركيب المواد الكيميائية بحيث يصبح الفهم والتعامل أفضل مثل استخدام الأعداد عوضاً عن كتابتها لغوياً.
- وتصبح هذه الصيغ ضرورة عند كتابة المعادلات المعبرة عن التفاعلات الكيميائية.
(23) تفاعل كيميائي Chemical Reaction
- تغير يطرأ على المواد، ويشمل تكسير روابط وإعادة تكوين روابط كيميائية وتترتب فيها الذرات بطريقة ينتج عنها مواد جديدة تختلف في خصائصها عن المواد المتفاعلة.
(24) الكيمياء Chemistry
- هي علم دراسة المادة، تركيبها وخواصها والتحولات التي يمكن أن تحدث لها وحدها أو عند وجود مادة أخرى معها>
- تتضمن الكيمياء دارسة الظواهر المجهرية مثل تفاعل الذرات وخواصها على مقياس دقيق وأيضاً الظواهر الأكبر حجماً مثل تفاعل جزيئات DNA والبروتينات في المحاليل المعقدة التركيب وخواص المواد الجديدة الناتجة.
(25) خواص ترابطية Colligative Properties
- خواص فيزيائية تتعلق بالمحاليل المخففة وتعتمد على عدد دقائق المذاب أكثر من اعتمادها على نوعه.
- وتشمل الخواص الترابطية كل من الانخفاض في درجة التجمد الانخفاض في الضغط البخاري، الارتفاع في درجة الغليان والضغط الاسموزي
(26) نظرية التصادم Collision theory
- هي نظرية تعالج سرعة التفاعلات بناءً على التصادمات التي تحدث بين المواد المتفاعلة.
(27) اتحاد Combination
- هو تفاعل يتم بين مادتين أو أكثر لتكوين مادة واحدة جديدة.
- يتم التعبير عن تفاعل الاتحاد بشكل عام كالآتي:
A + B → AB
- من الأمثلة على هذا النوع من التفاعلات تفاعل احتراق المغنيسيوم
2Mg + O2→ 2MgO
(28) القانون الجامع Combined Law
- هو قانون يجمع بين قانون بويل وقانون شارل وقانون غايلوساك في قانون واحد.
- وينص القانون على أن حجم عينة غازية يتناسب طردياً مع درجة حرارتها المطلقة وعكسياً مع الضغط الواقع عليها.
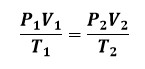
(29) تفاعل الاحتراق Combustion
- تفاعل المادة مع الأكسيجين وينتج عنه طاقة.
- عند حرق المادة يتكون أكسيد العنصر أو أكاسيد العناصر المحترقة.
- فمثلاً : عند حرق الكربون (الفحم) في جو شحيح الأكسجين يتكون أكسيد الكربون (أول أكسيد الكربون)
2C + O2 →2CO
- عند حرق الكربون (الفحم ) في جو غني بالأكسجين يتكون أكسيد الكربون (ثاني أكسيد الكربون).
- عند حرق المغنيسيوم يتكون أكسيد المغنيسيوم
C + O2 → CO2
2Mg + O2 → 2MgO
- عند حرق الميثان يتكون أكسيد الكربون ثاني أكسيد الكربون) وأكسيد الهيدروجين (الماء).
CH4 + O2→ CO2 + H2O
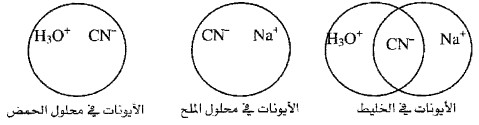
(30) أيون مشترك Common Ion
- الأيونين الشبيهين عند خلط محلول حمض مع ملحه أو محلول قاعدة مع ملحها
- كمثال على ذلك افرض أن لديك محلولاً لحمض الهيدروسيانيك HCN
-HCN + H2O → H3O+ + CN
- ولديك محلولاً آخر لملح سيانيد الصوديوم NaCN
-NaCN → Na + CN
وعند خلط المحلولين معاً يكون الأيون المشترك هو أيون السيانيد -CN
(31) تكوين المتراكبات Complex Formation
- تكوين المتراكبات هي مميزات بعض المواد الكيميائية التي لم تصل بعد إلى الحد الأقصى من التشبع الالكتروني على الرغم من كونها قد أنهت التفاعل الأولي.
- ويتم في تكوين المتراكبات انتقال كلي أو جزئي للإلكترونات بين المعطي والمستقبل.
- يسمى عامل تكوين المتراكبات Complexing agent وتعد أيونات العناصر الانتقالية من أشهر الأيونات المكونة للمتراكبات.
(32) المركب الكيميائي Compound
- هو مادة كيميائية تكونت من عنصرين أو أكثر بنسبة ثابتة تحدد تركيبه فمثلاً الماء (H2O) مركب يتكون من الهيدروجين والأكسجين بنسبة 1:2
(33) محلول مركز Concentrated Solution
- هو المحلول الذي يكون تركيز المذاب فيه عالياً.
(34) تركيز Concentration
- هي العلاقة النسبية بين المذاب والمذيب ويعبر عنها بعدة طرق منها: التركيز المولاري - التركيز المولالي.
(35) تكاثف Condensation
- تحول المادة من الحالة الغازية إلى الحالة السائلة.
(36) مبلمر تكثيف Condensation polymer
- المبلمر الناتج من تكثيف المونومرات ويرافقها انفصال جزيئات صغيرة مثل H2O
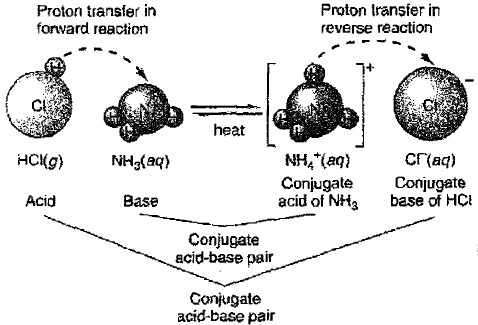
(37) حمض مرافق Conjugate acid
- الحمض الذي ينشأ من استقبال قاعدة برونستد - لوري لبروتون
مثال:
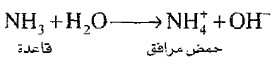
(38) قاعدة مرافقة Conjugated base
- القاعدة التي تنشأ من منح حمض برونستد - لوري لبروتون.
مثال:
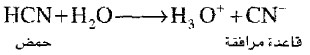
(39) زوج مرافق من حمض وقاعدة Conjugate acid - base pair
- هو زوج من الجزيئات أو الأيونات يختلفان في ذرة هيدروجين واحدة.