تفاعلات الإحلال Replacement Reactions
هناك الكثير من التفاعلات التى تتضمن إحلال عنصر محل عنصر آخر في مركب، وتسمى هذة التفاعلات تفاعلات الإحلال.
- هناك نوعان من تفاعلات الإحلال وهما:
(1) الأحلال البسيط
(2) الإحلال المزدوج
تفاعلات الإحلال البسيط
- تفاعلات الإحلال البسيط وهو التفاعل التى تحل فية ذرات عنصر محل ذرات عنصر آخر في مركب
- المعادلة العامة لتفاعلات الإحلال البسيط هي:
A + BX → AX + B
(1) إحلال فلز محل الهيدروجين
- هو أحد أنواع تفاعلات الإحلال البسيط حيث تحل ذرة فلز محل ذرة هيدروجين فى مركب.
- التفاعل بين الليثوم والماء أحد الأمثلة على على هذا النوع.
- حيث تحل ذرة فلز (الليثوم) محل ذرة واحدة من ذرتي هيدروجين في جزئ الماء
(2Li(s) + 2H2O(l) → 2LiOH(aq) + H2(g

(2) إحلال فلز محل فلز آخر
- - يحدث نوع آخر من الإحلال البسيط عندما يحل فلز محل فلز آخر في مركب مذاب فى الماء.
- يبين الشكل التالي حدوث تفاعل احلال بسيط عند وضع صفيحة من النحاس في محلول مائي من نترات الفضة. فالبلورات المتراكمة على قطعة النحاس هي ذرات الفضة التى حلت محلها ذرات النحاس.
(Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag(s

سلسلة النشاط الكيميائي للفلزات
- لا يحل الفلز دائماً محل فلز آخر في مركب مذاب في الماء، وذلك لأن الفلزات تختلف في نشاطها.
- يقصد بالنشاط هنا مقدرة الفلز على التفاعل مع مادة أخرى.
- يبين الشكل التالي سلسلة النشاط الكيميائي لبعض الفلزات:
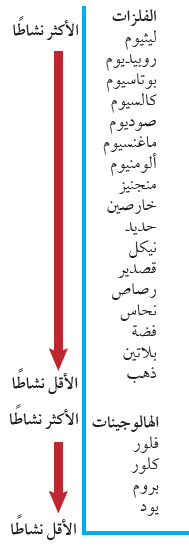
- تستخدم تفاعلات الإحلال في تحديد موقع الفلزات فى السلسلة حيث يوجد أنشط الفلزات في أعلى السلسلة ، بينما يوجد أقلها نشاطاً في أسفلها.
- يمكنك استعمال سلسلة النشاط الكيميائي لتتوقع ما إذا كان سيحدث تفاعل أم لا. إن أي فلز يمكنه أن يحل محل أي فلز يقع بعده في سلسلة النشاط الكيميائي، ولكن لا يمكنه أن يحل محل أي فلز يقع قبله.
فمثلاً تحل ذرات النحاس محل ذرات الفضة في محلول نترات الفضة، ولكن لو وضعت سلكاً من الفضة في محلول نترات النحاس II فإن ذرات الفضة لا تحل محل ذرات النحاس، لأن الفضة تقع بعد النحاس في سلسلة النشاط الكيميائي ولهذا لا يحدث التفاعل.
Ag(s) + Cu(NO3)2(aq) → No Reaction
(3) احلال لافلز محل لافلز آخر
هناك نوع ثالث من تفاعلات الإحلال البسيط، حيث يحل فيه لافلز محل لافلز آخر في مركب. كما هو شائع في بعض تفاعلات الهالوجينات.
- الهالوجينات لافلزات وهي كالفلزات فهي تظهر مستويات مختلفة من النشاط في تفاعلات الإحلال
- يبين الشكل التالي سلسلة النشاط للهالوجينات

- تبين السلسلة أن الفلور أنشط الهالوجينات واليود أقلها نشاطاً.
- الهالوجين الأنشط يحل محل الهالوجين الأقل نشاطاً في مركب ذائب فى الماء
فالفلور مثلاً يحل محل البروم في محلول مائي لبروميد الصوديوم . لكن لايحل البروم محل الفلور في محلول مائي لفلوريد الصوديوم.
(F2(g) + 2NaBr(aq) → 2NaF(aq) + Br2(l
Br2(l) + 2NaF(aq) → No reaction