كلوريد الألومنيوم Aluminium chloride
- كلوريد الألومنيوم هو مركب كيميائي له الصيغة AlCl3 ، ويعد من أحماض لويس القوية
- يتواجد كلوريد الألومنيوم على شكلين:
(1) خالي من الماء ويطلق عليه كلوريد الألومنيوم اللامائي وصيغته الكيميائية AlCl3
(2) مرتبط مع ست جزيئات من الماء؛ سداسي هيدرات كلوريد الألومنيوم AlCl3.6H2O
- يكون كلوريد الألومنيوم اللامائي في شكله النقي على شكل بلورات بيضاء ، إلا أنها تصبح صفراء بوجود آثار من كلوريد الحديد.

- تتميز بلورات كلوريد الألومنيوم اللامائي أنها شغوفة للرطوبة بحيث أنها تدخن بوجود هواء رطب.
الرابطة فى كلوريد الألومنيوم
- يكون الألومنيوم فلز يوجد فى المجموعة 13 لذلك فهو يكون أيون 3+Al . لكن ليس لدية كهروإيجابية عالية والكثافة العالية لشحنة الأيون 3+Al الصغير تسمح له باستقطاب سحابة الشحنة السالبة على الأيونات السالبة المتكونة من الذرات ذات السالبية الإلكترونية الأقل.
- الفرق فى السالبية الكهربية بين الألومنيوم (1.5) والكلور (3) يكون 1.5 ولهذا فأن هذا الفرق فى السالبية الكهربية تقع بين الحد الفاصل بين الرابطة الأيونية والرابطة التساهمية.
- ولذلك فأن كلوريد الألومنيوم:
- فى درجات الحرارة المنخفضة يكون كلوريد الألمونيوم فى الحالة الصلبة رابطة أيونية نقية Pure Ionic bond
- في درجات الحرارة المرتفعة يكون كلوريد الألومنيوم رابطة أيونية بخصائص تساهمية عالية جداً Ionic bond with Covalent character ولذلك يقال أن الرابطة المتكونة فى هذة الحالة رابطة تساهمية.

- يرجع السبب فى ذلك إلى الكثافة العالية للشحنات الموجبة Al+3 التى تستقطب سحابة الشحنة السالبة للكلور -Cl وتكون رابطة آيونية بخصائص تساهمية لذلك يتم اعتبار الرابطة فى كلوريد الألومنيوم رابطة تساهمية.
درجة انصهار كلوريد الألومنيوم
- ونتيجة لتكون الروابط الأيونية ذات الخواص التساهمية فى جزئ كلوريد الألومنيوم فأن:
- درجة انصهار كلوريد الألومنيوم اللامائي = 192.6 سلزيوس
- درجة انصهار كلوريد الألومنيوم المائي = 100 سلزيوس
السبب فى الانصهار والتسامى لكلوريد الألومنيوم
- عند درجة حرارة 180-190 سلزيوس (يعتمد على الضغط) يتحول AlCl3 إلى Al2Cl6 اى dimer وتتكون رابطة تناسقية بين جزيئين من كلوريد الالومنيوم (Co-Ordination bond (dative bond مما يؤدي لضعف قوى التجاذب النسبية بين الجزئيات مقارنة بقوى التجاذب القوية بين الأيونات.

- الجزئ Al2Cl6 هو نتيجة ارتباط جزيئين (dimer) من كلوريد الألومنيوم AlCl3
- ونتيجة هذا التحول فأن كلوريد الألومنيوم يفقد جميع الخواص الأيونية ويؤدي إلى الأنصهار والتسامي.
- ويكون دائما AlCl3 , Al2Cl6 فى حالة اتزان كالتالي:
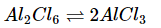
وعند ارتفاع درجة الحرارة فأن الأتزان يسير نحو تكون AlCl3
الخلاصة
- فى درجة حرارة الغرفة فأن كلوريد الألومنيوم الصلب يكون شبكة بلورية آيونية ذات خواص تساهمية.
- عند درجة حرارة 180-190 سلزيوس (يعتمد على الضغط) يتحول AlCl3 إلى Al2Cl6 وهذا هو سبب الانصهار والتبخر لكلوريد الألومنيوم وذلك لضعف قوى التجاذب النسبية بين الجزئيات
- عند ارتفاع درجة الحرارة فأنه يتكون المزيد من كلوريد الألومنيوم AlCl3 مرة أخري.