(1) المولارية Molarity
- هي عدد مولات المادة المذابة في لتر من المحلول.
- المحلول هنا = حجم المذاب + حجم المذيب
- نستخدم العلاقة :

(2) المولالية Molality
- هي عدد مولات المادة المذابة في كيلو جرام من المذيب.
- نستخدم من العلاقة:

(3) العلاقة بين المولارية والمولالية
العلاقة التالية هى التى تربط بين المولارية والتركيز المولالي :
(d = M (1/m + Mwt/1000
حيث يكون:
M = molarity
m= molality
Mwt= molar mass of solute
d= density in g/cm³
(4) أثبات العلاقة التى تربط بين المولارية والمولالية

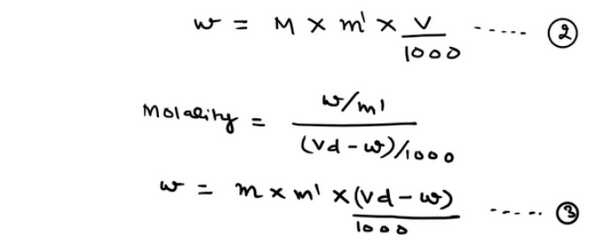
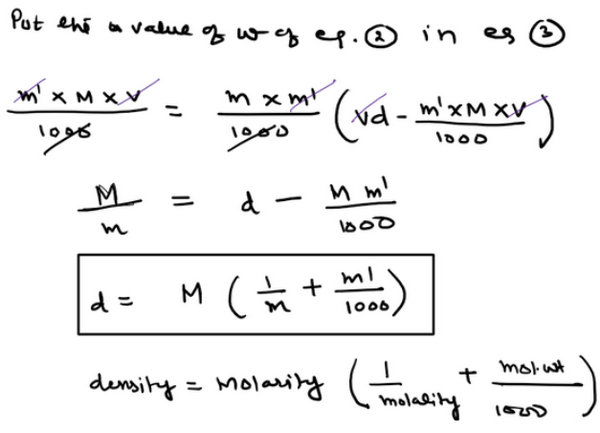
ويمكن كتابتها على الصورة التالية:
(d = M (1/m + Mwt/1000
حيث يكون:
M = molarity
m= molality
Mwt= molar mass of solute
d= density in g/cm³