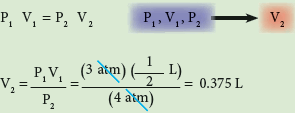قانون بويل للغازات Boyles,s Law
- ضغط الغاز وحجمه مترابطان. وقد وصف العالم الإيرلندي روبرت بويل هذة العلاقة.
- قانون بويل هي علاقة تربط بين ضغط الغاز وحجمه.
كيف يرتبط الضغط مع الحجم
- صمم بويل تجربة كالموضحة فى الشكل التالي:

- وضح بويل من خلالها أنه إذا كانت كمية الغاز ودرجة الحرارة ثابتتين فإن مضاعفة الضغط الواقع على الغاز يقلل من حجمه إلى النصف. ومن ناحية أخرى فإن تقليل الضغط الواقع على الغاز إلى النصف يضاعف حجم الغاز.
- لذلك لاحظ بويل أن حجم الغاز يقل كلما زاد الضغط المسلط عليه والعكس صحيح وذلك عند تثبيت درجة الحرارة وكمية الغاز.
نص قانون بويل
يتناسب حجم الغاز عكسياً مع الضغط المسلط عليه عند ثبوت درجة الحرارة وكمية الغاز
الشكل الرياضى لقانون بويل
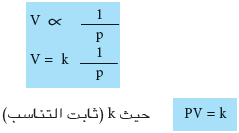
- أى أن حاصل الضرب للضغط والحجم بأية حال يساوي كمية ثابتة.
- عند أخذ عينة من غاز ذات حجم V1 تحت ضغط P1عند درجة حرارة ثابتة وقمنا بتغيير ظروف هذا الغاز ليصبح حجمه V2 وضغط P2 مع الاحتفاظ بدرجة الحرارة ثابتة T1 فأنه طبقا لقانون بويل يصح أن نقول:
عند ثبوت الحرارة وكمية الغاز
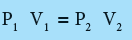
العلاقة البيانية بين الضغط والحجم
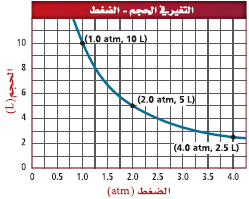
لاحظ أن ناتج ضرب الضغط في الحجم عند كل نقطة فى الشكل يساوي مقدار ثابت وهو 10atm.L
تمرين محلول
ضغط غاز في صفيحة معطر جو يساوي 3atm وحجمه نصف لتر ما حجمه عندما يصبح الضغط المسلط عليها 4atm.
الحل: