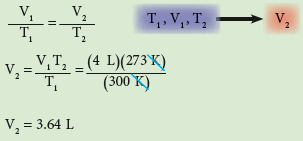قانون شارل Charles,s Law
- هو قانون يربط بين حجم الغاز ودرجة الحرارة عند ثبوت الضغط.
- درس الفيزيائي الفرنسي جاك شارل العلاقة بين الحجم ودرجة الحرارة حيث لاحظ أن كلاً من درجة حرارة وحجم عينة من الغاز يزداد عندما تبقي كل من كمية العينة والضغط ثابتين.
- أن جميع الغازات تتمدد في الحجم عندما ترفع درجة حرارتها، ويمكن عمليا قياس الزيادة في الحجم بزيادة درجة الحرارة وذلك بحبس كتلة ثابتة لغاز في اسطوانة مزودة بمكبس كماهو مبين بالشكل:

- حيث ان الكتلة فوق قمة المكبس ثابتة فأن العينة من الغاز تبقى عند ضغط ثابت ويلاحظ انه كلما سخن الغاز فان المكبس
يتحرك للخارج ويزداد الحجم
نص قانون شارل
يتناسب حجم كمية محدودة من الغاز تناسباً طردياً مع درجة الحرارة المقاسة بالكلفن عند ثبوت الضغط وكمية الغاز.
العلاقة الرياضية لقانون شارل

- حاصل قسمة حجم كمية محددة من الغاز على درجة حرارته بالكلفن عند ثبوت ضغطه يساوي كمية ثابتة.
- لاحظ أن درجة الحراة هنا بالكلفن وهي:
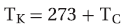
- وفي كثير من الاحيان نتعامل مع حجمين V1 , V2 لكمية معينة من غاز عند درجتي حرارة مختلفتين T1 , T2 على التوالي لذلك يمكن استخدام العلاقة العامة للحجم ودرجة الحرارة عند ثبوت الضغط وكمية الغاز كالآتي:
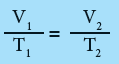
رسم العلاقة بين الحجم ودرجة الحرارة (قانون شارل)

- فى الرسم البيانى الأول درجة الحرارة التى يكون عندها الحجم 0L تساوي 273Co- لذا فأن العلاقة خطية لكنها ليست تناسباً مباشراً فمثلاً يمكنك ملاحظة عدم مرور الخط المستقيم بنقطة الأصل، كما أن مضاعفة درجة الحرارة من 25Co إلى 50Co لا تؤدي إلى مضاعفة الحجم.
- يبين الرسم البياني أن العلاقة بين درجة الحرارة بالكلفن والحجم علاقة طردية والتناسب مباشر إذ تقابل درجة حرارة 0K حجماً مقداره 0ml وعند مضاعفة درجة الحرارة يتضاعف الحجم .
- يعرف الصفر على تدريج كلفن باسم " الصفر المطلق" وهو يمثل أقل قيمة ممكنة لدرجة حرارة التى تكون عندها طاقة الذرات أقل ما يمكن.
تفسير قانون شارل حسب نظرية الحركة الجزيئية
- يمكن تفسير قانون شارل بناءاً على نظرية الحركة الجزيئية: فعندما تزداد درجة الحرارة تتحرك جسميات الغاز وتصطدم أسرع بجدار الإناء الذي توجد فيه وبقوة أكبر ولأن الضغط يعتمد على عدد وقوة اصطدامات جسيمات الغاز بجدار الإناء فإن هذا يؤدي إلى زيادة الضغط.
- وحتى يبقى الضغط ثابتاً لابد أن يزيد الحجم إذ تحتاج الجسيمات إلى الانتقال إلى مسافات أبعد قبل أن تصطدم بالجدار مما يقلل من عدد اصطدامات الجسيمات بجدار الإناء.
تمرين محلول
ملئ بالون (نفاخة) بالهواء حتى أصبح حجمه 4L بدرجة حرارة 27Co ما حجم البالون بعد وضعه في الثلاجة علما بأن درجة حرارتها 0Co (الضغط ثابت في الحالتين) ؟
الحل :
اولاً : نحول درجتي الحرارة من C° الى K بالقانون الاتي:
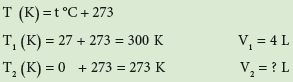
ثانياً : نجد الحجم بعد تغير درجة الحرارة باستخدام قانون شارل: