الأتزان الكيميائي
- هو نظام ديناميكى يحدث عندما يتساوى معدل التفاعل الطردى مع معدل التفاعل العكسى وتثبت تركيزات كل من المتفاعلات والنواتج.
ثابت الإتزان
- ھو مقدار ثابت يعبر عن حالة الإتزان التي تصل إليھا مجموعة من المواد الكيميائية المتفاعلة عكسياً.
- وقيمة ثابت الإتزان ثابتة عند درجة ً عندما تكون سرعتا التفاعلين العكسيين متساوية ً.
- ومن قانون فعل الكتلة فإن ھذا الثابت له قيمة ھي عبارة عن حرارة معينة ويتم الحصول عليه تجريبيا كسر بسطه حاصل ضرب تراكيز المواد الناتجة ومقامه حاصل ضرب تراكيز المواد المتفاعلة، مرفوع تركيز كل مادة منھا الى أس يساوي معامله في المعادلة الموزونة.
العوامل المؤثرة على ثابت الأتزان
(1) طبيعة المواد الداخلة والناتجة من التفاعل.
(2) درجة الحرارة.
العوامل المؤثرة على موضع الأتزان
(1) إضافة حافز.
(2) تغيير درجة الحرارة.
(3) تغيير التركيز.
(4) تغيير الضغط.
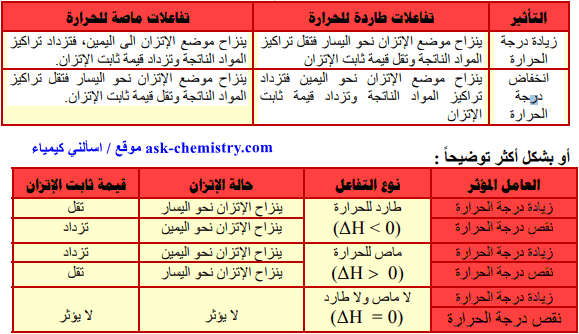
تأثير تغيير درجة الحرارة على موضع الأتزان
- لا تتغير قيمة ثابت الإتزان الكيميائي الإ بتغيير درجة الحرارة فقط.
- توضح قاعدة لوشاتيلية بأنه "إذا أثر مؤثر خارجي (مثل الضغط أو التركيز أو درجة الحرارة) على تفاعل ما في حالة اتزان، فإن ھذا التفاعل يسير في الإتجاه الذي يقلل من تأثير ذلك المؤثر، حيث يصل التفاعل الى حالة اتزان جديدة"
- يؤدي رفع درجة الحرارة الى زيادة سرعة التفاعل الكيميائي، ولقد حددت معادلة أرھينيوس العلاقة بين درجة حرارة التفاعل وثابت سرعة التفاعل :
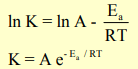
ومنھا يمكن ملاحظة أن قيمة ثابت سرعة التفاعل تتناسب طردياً مع درجة الحرارة.
حيث:
K : ثابت سرعة التفاعل
A : ثابت يعرف بمعامل التردد.
Ea : طاقة التنشيط للتفاعل بوحدة الجول
R : الثابت العام للغازات = 8.314J /mol.K
T : درجة الحرارة المطلقة بوحدة (K)
ويمكن تلخيص أثر زيادة درجة الحرارة أو نقصانھا على موضع االإتزان وثابت االإتزان بالجدول التالي: