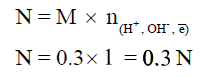(1) المولارية Molarity
- هي عدد مولات المادة المذابة في لتر من المحلول.
- المحلول هنا = حجم المذاب + حجم المذيب
- نستخدم العلاقة :

(2) العيارية Normality
ھي عدد الأوزان المكافئة الجرامیة (Eq) من المادة المذابة الموجودة في لتر من المحلول (Vsol)

(3) العلاقة بين المولارية والعيارية
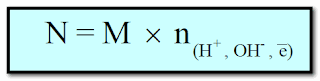
حيث n : تعبر عن عدد المولات من وحدات أيونات الهيدروجين (H+) أو الهيدروكسيد (OH-) أو عدد الإلكترونات المشاركة فى تفاعلات الأكسدة والاختزال .
ومن العلاقة السابقة عندما تكون n =1 فأن المولارية = العيارية
مثال: أحسب التركيز بالعيارية لحمض HCl تركيزه 0.3M ؟
الحل : عدد ذرات الهيدروجين = 1