لماذا جزيء الهيدروجين أصغر حجماً بكثير من ذرة الهيدروجين المفردة ؟
- يتكون جزيء الهيدروجين H2 من ذرتي هيدروجين، تملك كل ذرة هيدروجينية الكتروناً واحداً، يشغل المدار 1s.
- المدار 1s هو كرة ينطبق مركزها على نواة الذرة. ولكي تتشكل الرابطة، يجب أن تقترب النواتان الى درجة تكفي لحدوث تراكب المدارات الذرية .
- في حالة الهيدروجين تكون المنظومة في حالة الاستقرار الاعظم عندما تكون المسافة بين النواتين مساوية A 0.74، تدعى هذه المسافة "طول الرابطة bond length".
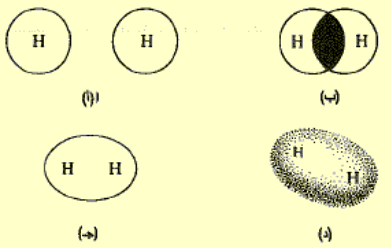
- جزئ الهيدروجين هو أصغر حجم جزئ موجود.
- يملك المدار الرابط، تقريباً، الشكل الذي نتوقعه لدى اندماج مدارين من نوع (s). وكما يظهر فى الشكل السابق فإنه على هيئة النقانق sausage بحيث يتوضع محورها الطويل وفق الخط الواصل بين تجمع النواتين. وهو مدار متناظر أسطوانياً حول هذا المحور الطويل، أي أن مقطع النقانق يكون دائري. تسمى المدارات الرابطة التي لها هذا الشكل المدارات a (مدارات سيغما) وتدعى الروابط،.
- ويمكن أن نصور جزيء الهيدروجين على شكل نواتين مغمورتين ضمن سحابة الكترونية واحدة على هيئة النقانق. تكون هذه السحابة أكثف ما يمكن في المنطقة الواقعة بين الذرتين، حيث تجذب الشحنة السالبة أشد ما يمكن من قبل الشحنتين الموجبتين.
- إن حجم جزيء الهيدروجين – كما قيس بواسطة الحجم الموجود داخل السطح الاحتمالي 95% أصغر بكثير من حجم ذرة الهيدروجين المفردة.
- قد نستغرب ذلك في البداية، إلا أن تناقص السحابة الالكترونية هو ما يجب أن نتوقعه. إن الجذب الهائل الذي تقوم به النواتان للالكترونين هو الذي يعطي الجزيء استقراره الكبير بالمقارنة مع الذرتين المعزولتين؛ وهذا يجب أن يعني أن الالكترونين قد ثبتا بشكل وثيق في موقع أقرب مما عليه الحال في الذرتين.