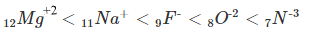التساوي الإلكتروني Isoelectronic species
- هي ذرات أو جزيئات أو أيونات لها نفس العدد من الإلكترونات أو لديها نفس التوزيع الإلكتروني ونفس البنية، وذلك بغض النظر عن نوع العناصر الداخلة في التركيب.
- مثال : -N−3, O−2, Mg2+, Na+, F جميع هذة الأيونات لها نفس عدد الألكترونات وهو 10 لذا يطلق عليها
isoelectronic species
المقارنة بين أحجام الأيونات التى لها نفس التوزيع الألكتروني
- إذا كانت الأيونات المشتقة من ذرات مختلفة متساوية في عدد الإلكترونات isoelectronic species ، فحينئذٍ يكون لها جميعًا نفس العدد من الإلكترونات في غلافها الإلكتروني وسيكون لها نفس التوزيع الألكتروني ولكن شحنتها النووية ستختلف بسبب اختلافها في عدد البروتونات في النواة.
- مع زيادة عدد البروتونات في النواة ، تنجذب الإلكترونات أكثر نحو النواة ، مما يتسبب في انخفاض نصف القطر الأيوني.
- للأيونات التى لها نفس التوزيع الألكتروني isoelectronic species فأن إنخفاض الشحنة النووية يؤدي إلى زيادة حجم الأيونات.
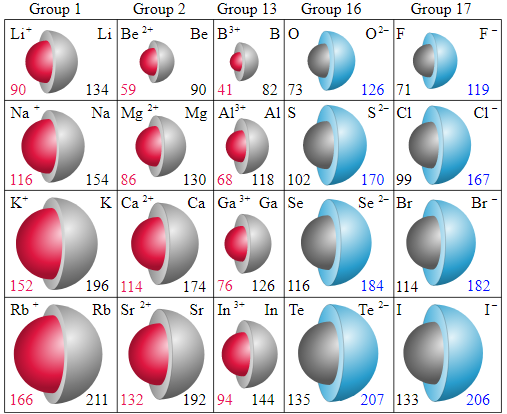
- وفيما يلي جدول يوضح أحجام ايونات بعض الذرات وأيوناتها بوحدة pm
مثال: رتب الأيونات التالية حسب حجم الأيون :
-N−3 , O−2 , Mg2+ , Na+ , F
الحل:
كل الأيونات السابقة لها نفس التوزيع الألكتروني وهو 1s2 , 2s2 2p6
-7N3 ← عدد البروتونات = 7 ، عدد الإلكترونات = 10
-8O2 ← عدد البروتونات = 8 ، عدد الإلكترونات = 10
-9F ← عدد البروتونات = 9 ، عدد الإلكترونات = 10
+11Na ← عدد البروتونات = 11 ، عدد الإلكترونات = 10
+12Mg2 ← عدد البروتونات = 12 ، عدد الإلكترونات = 10
نجد أن جميع الأيونات السابقة لها نفس عدد الألكترونات ولكن تختلف فى عدد البروتونات.
- ومع زيادة عدد البروتونات في النواة ، تنجذب الإلكترونات أكثر نحو النواة ، مما يتسبب في انخفاض نصف القطر الأيوني.
- الخلاصة: للأيونات التى لها نفس التوزيع الألكتروني isoelectronic species فأن إنخفاض الشحنة النووية يؤدي إلى زيادة حجم الأيونات.