لماذا لا يحترق الماء
- أولاً بشكل عام لا ينبغي على الإطلاق ربط خواص المركبات بخواص العناصر المكونه لها، لأنه أثناء التفاعلات تتغير الروابط بين ذرات هذه العناصر و الأمثلة عديدة.
- فمثلاً الهيدروجين يشتعل بفرقعة و الأكسجين أساسي لجميع عمليات الإشتعال و لكن بمفاعلتهم سويا تتغير الزوايا بين الروابط بل و تتكون روابط جديدة كما تتغير بنية الأوربيتالات مغيرة شكل السحابة الإليكترونية حول كل ذرة و بالتالي تتغير خواص المركب الناتج.
- الإشتعال ( الأحتراق) : هي عملية أكسدة سريعة (أي تفاعل مع الأكسجين) تفقد فيها الذرات جزء من طاقتها في صورة ضوء و حرارة (و اللهب الذي نراه ما هو إلا الطاقة الناتجة من انتقال الإلكترونات لمستويات طاقة أقل) و بعد تمام التفاعل تصبح المادة المحترقة في حالة أكثر استقراراً و أكثر تشبعاً بالأكسجين لذلك لا تشتعل مرة أخرى.
- الخشب مثلاً قابل للإشتعال (و هو مركب بشكل أساسي من كربون و هيدروجين) و لكن عملية الإشتعال ينتج عنها أكسدة الكربون إلى ثاني أكسيد الكربون و أكسدة الهيدروجين إلى أكسيد الهيدروجين (أي الماء!) و كلاهما غير قابل للإشتعال لأنهما مشبعان بالفعل بالأكسجين؛ حتى أن الرماد الناتج من الإحتراق يكون غير قابل للإشتعال ؛ ببساطة لأن المادة لم يعد لديها طاقة تفقدها في صورة لهب
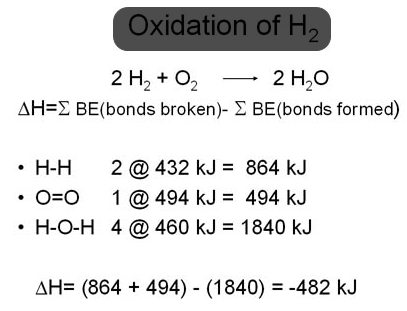
- عند إحتراق غاز الهيدروجين وحده فإنه يتأكسد إلى أكسيد الهيدروجين (أي الماء!) و نظراً لأن الماء هو ناتج تفاعل الإحتراق فهو مستقر ومشبع بالأكسجين لذلك لا يتأكسد (أي لا يحترق!). و تسري هذه القاعدة على أي نواتج عملية أكسدة (خلاف الماء و ثاني أكسيد الكربون!) فسبحان الخلاق الذي خلق الشيء و نقيضه من نفس الأصل.