فى البداية وحتى تتضح الأمور سوف نتكلم عن الألوان فى العناصر الانتقالية لأنها أكثر العناصر الملونة فى الجدول الدوري وأسباب وجود تلك الألوان.
العلاقة بين ألوان أيونات العناصر الانتقالية وتركيبها الألكتروني
- يوضح الجدول التالي بعض الأيونات المتهدرتة لفلزات السلسلة الانتقالية الأولي:
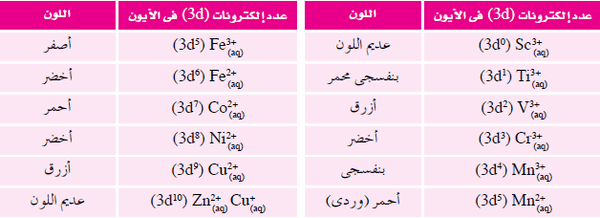
- وبمراجعة الجدول السابق نجد أن أيونات +d10) Zn2+ ، (d10) Cu1+ ، (d0) Sc3) غير ملونة.
- أيونات العناصر غير الانتقالية فهي تتميز أما باحتوائها على أوربتالات (d) فارغة (d0) أو ممتلئة تماماً (d10).
- من ذلك نستنتج أن اللون في أيونات العناصر االانتقالية يعزي إلى الامتلاء الجزئي (1:9e) لأوربتالات المستوى الفرعي (d) أى لوجود إلكترونات منفردة في أوربتالات (d).
ملاحظات هامة
(1) تكون الأيونات غير ملونة عندما تكون أوربيتالات (d) فارغة أو ممتلئة بالإلكترونات d10 & d0
(2) تكون الأيونات ملونة عندما يكون المستوى الفرعي (d) غير ممتلئ بعشرة إلكترونات من 1 إلى 9
(3) أيونات العناصر الغير انتقالي غير ملونة لان اوربيتالات المستوى الفرعى (d) فارغة من الإلكترونات والطاقة اللازمة لإثارة الإلكترونات المفردة فى اوربيتالات P & S أعلى من طاقة الضوء المرئي.
(4) أيون Cu+1 عديم اللون ولكن Cu+2 ازرق اللون وذلك لأن Cu+1 عديم اللون لان جميع الاوربيتالات فى المستوى الفرعي (3d) ممتلة بالإلكترونات Ar] 3d104S0] ، أما Cu+2 لونه ازرق لان ايونه امتص اللون البرتقالي وعكس اللون المتتم وهو اللون الأزرق لان اوبيتالات المستوى الفرعي (3d) غير تامة الامتلاء بالإلكترونات Ar]3d9 4S0] وتحتوى على إلكترون مفرد
(5) أيونات الصوديوم والبوتاسيوم غير ملونة لأن اوربيتالات المستوى الفرعي (d) فارغة من الإلكترونات والطاقة اللازمة لإثارة الإلكترونات المفردة فى اوربيتالات P&S أعلى من طاقة الضوء المرئي.
(6) أيون Ti +3 بنفسجي محمر ولكن أيون Ti +4 غير ملون لأن Ti+3 تركيبه الإلكتروني Ar]18 3d1 4S0] لأن به إلكترون مفرد فى أوربيتالات المستوى الفرعي (3d) يؤدى ذلك إلى امتصاص اللون الأخضر وينعكس اللون البنفسجي المحمر أما أيون Ti+4 غير ملون لأن تركيبه الإلكتروني Ar] 3d0 4S0] فيكون المستوى الفرعي (3d) خالي من الإلكترونات.
هل محاليل الالمونيوم المائية ملونة أم غير ملونة Al+3؟
أيونات الألومنيوم غير ملونة (عديمة اللون colourless) لأن اوربيتالات المستوى الفرعي (d) فارغة من الإلكترونات والطاقة اللازمة لإثارة الإلكترونات المفردة فى اوربيتالات P&S أعلى من طاقة الضوء المرئي.
Al+3 : 1s2 ,2s2 2p6
أمثلة:
(1) كبريتات الألومنيوم Al2(SO4)3 يكون على شكل بلورات إبرية عديمة اللون.
(2) نترات الألمنيوم Al(NO3)3 ، ويرتبط بالعادة مع تسع جزيئات ماء Al(NO3)3.9H2O ، ويكون على شكل بلورات عديمة اللون.
(3) كلوريد الألومنيوم AlCl3 ويتواجد على شكلين، إما خالي من الماء (شكل لامائي)، أو مرتبط مع ست جزيئات من الماء؛ سداسي هيدرات كلوريد الألومنيوم AlCl3.6H2O ويكون على شكل بلورات عديمة اللون.