تفاعلات الرتبة الثانية Second-Order reaction
- تُعد تفاعلات المرتبة الثانية من أكثر الحالات في التفاعلات الكيميائية.
- يمكن تصنيف هذا النوع من التفاعلات إلى صنفين رئيسيين هما:
(1) التفاعلات التي تحتوي على مادة واحدة متفاعلة أو تحتوي على مادتين ولكن بتراكيز متساوية
- يمكن التعبير عن هذا النوع بالمعادلات الآتية:
2A → Products
A + B → Products
على أن تكون تراكيز كل من A , B متساوية.
- إذا كان التركيز الأبتدائي للمواد المتفاعلة هو (a) ، فأنه بعد مرور فترة زمنية معينة (t) يتكون الناتج بتركيز مقداره (x) وتخنفص تركيز المواد المتفاعلة (تركيز المادة المتفاعلة الواحدة) إلى (a-x).
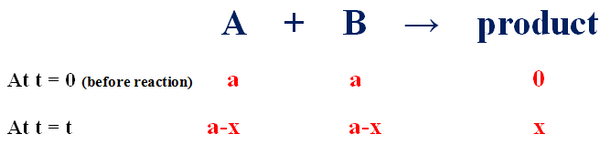
- يمكن تمثيل معدل سرعة تكون النتائج d[x] / dt بالمعادلة التالية:
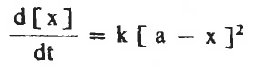
وبعد فصل المتغيرات عن بعضها يمكن إجراء التكامل لهذة المعادلة كالتالي:

- وعند رسم العلاقة الخطية للمعادلتين (1) , (2) أى بين 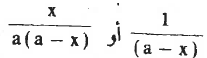 والزمن يؤدي ذلك إلى خط مستقيم ويكون الميل = K (ثابت معدل السرعة)
والزمن يؤدي ذلك إلى خط مستقيم ويكون الميل = K (ثابت معدل السرعة)
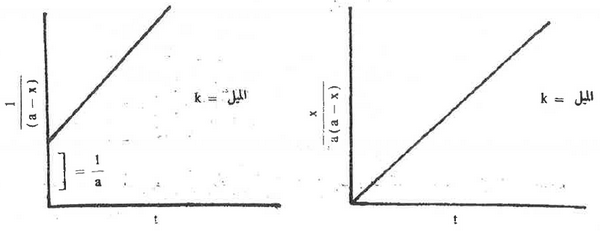
- وبهذه الطريقة يمكن حساب ثابت معدل سرعة التفاعل من مسيل الخط المستقيم الذي يجب ان يمر بنقطة الأصل حين تطبيق المعادلة (2) أو يعطي قطعاُ مكافئاُ لمقلوب التركيز الغبتدائي حين تطبيق المعادلة (1)
(2) التفاعلات الحاوية على مادتين متفاعلتين وبتراكيز مختلفة
- يمكن التعبير عن هذا النوع من التفاعلات بالمعادلة الآتية:
A + B → Products
حيث التركيز الأبتدائي للمادة (ِA) هو (a) وللمادة (B) هو (b) ، فأنه بعد مرور فترة زمنية معينة (t) يتكون الناتج بتركيز مقداره (x) وتنخفض تركيز المادة المتفاعلة (A) إلى (a-x) وتنخفض المادة المتفاعلة (B) إلى (b-x).
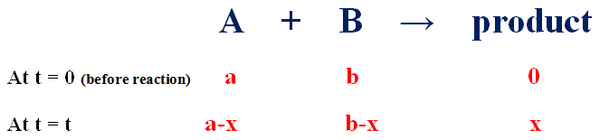
- يمكن التعبير عن معادلة السرعة كالتالي:
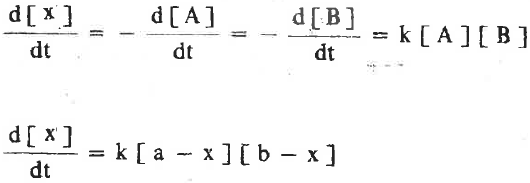
وذلك على افتراض أن التفاعل من الرتبة الأولى لكل من (A) , (B) وعند فصل المتغيرات نحصل على :
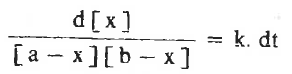
وبإجراء التكامل لهذة المعادلة نحصل على:
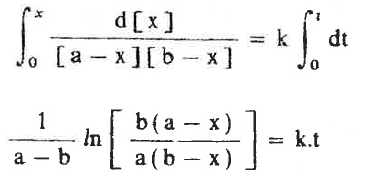
ويمكن تبسيط هذة المعادلة لتكون بالشكل التالي:
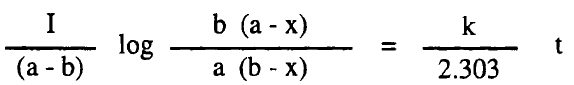
- وهذة هي المعادلة الحركية لتفاعل من الرتبة الثانية يتضمن مادتين مختلفتين.
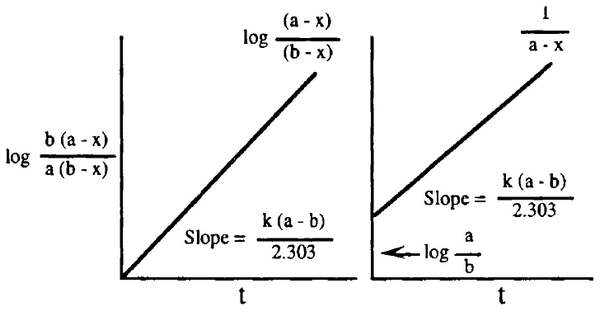
- نرسم العلاقة بين 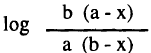 والزمن يعطي خطاً مستقيماً ماراً بنقطة الأصل وله ميل يساوي
والزمن يعطي خطاً مستقيماً ماراً بنقطة الأصل وله ميل يساوي 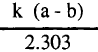 كما هو مبين بالشكل التالي:
كما هو مبين بالشكل التالي:
فترة نصف العمر لتفاعلات الرتبة الثانية
- تعرف فترة نصف العمر (t1/2) لأي تفاعل بأنها :
الزمن اللازم لكي ينخفض تركيز المادة المتفاعلة إلى نصف قيمته الأولية
أو الزمن اللازم لإتمام نصف التفاعل"
- لا يمكن تعيين فترة عمر النصف عندما تختلف تركيزات المواد A ، B لأن كل منهما لها قيمة مختلفة من فترة نصف العمر ولكن يمكن تعيينها إذا كانت التركيزات متساوية أو إذا كانت المادتان المتفاعلتان من نفس النوع>
- وبالتعويض عن (x) بالقيمة a/2 فى المعادلة (1) او (2) أعلاه يمكن الحصول على فترة نصف العمر:
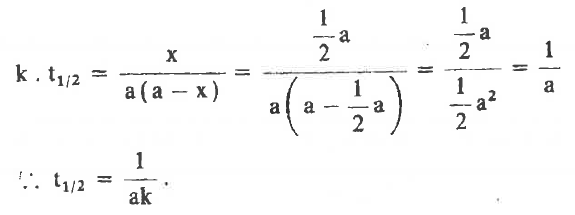
أى انه في تفاعلات الرتبة الثانية تتناسب فترة نصف العمر تناسباً عكسياً مع التركيز الابتدائي.