أعداد التأكسد Oxidation Number
- توصف عمليات او تفاعلات التأكسد والاختزال بدلالة أعداد سالبة وموجبة والصفر تُكتب فوق رمز العناصر المشتركة فيها وتسمى اعداد التاكسد او تسمى حالات التاكسد.
- يمثل عدد التأكسد لكل ذرة موجودة في جزيء مركب الشحنة الكهربائية (عدد الالكترونات) التي تفقدها او تكتسبها تلك الذرة.
- الجدول التالي يوضح أعداد التأكسد التى من الممكن أن تتواجد عليها هذة العناصر

القواعد المستخدمة لحساب اعداد التأكسد
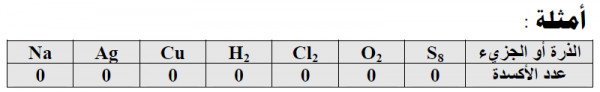
(1) عدد الأكسدة للعنصر النقي (الحر) غير المرتبط بغيره (ذرة أو جزئ) يساوي صفراً.
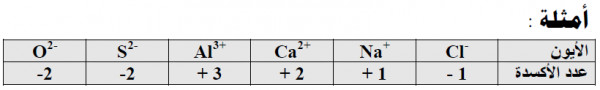
(2) عدد الأكسدة للايونات أحادية الذرة يساوي شحنتها.
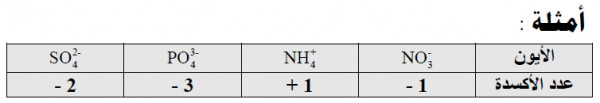
(3) مجموع أعداد الأكسدة لجميع الذرات في ايون يجب أن تساوي الشحنة الموجودة على ذلك الأيون.
(4) مجموع أعداد الأكسدة لجميع الذرات فى مركب متعادل (لا يحمل شحنة) يساوي صفراً.

(5) عدد الأكسدة للهيدروجين في جميع مركباته هو (+1) باستثناء هيدريدات الفلزات مثل هيدريد الصوديوم (NaH) وهيدريد الكالسيوم (CaH2) فإن عدد الأكسدة له (-1).
(6) عدد الأكسدة للأكسجين فى جميع مركباته (-2) ماعدا :-
(أ) مركبات فوق الأكسيد مثل فوق أكسيد الهيدروجين (H2O2) وفوق أكسيد الصوديوم (Na2O2) وفوق أكسيد البوتاسيوم (K2O2) وفوق أكسيد الكالسيوم (CaO2) فأن عدد الأكسدة للأكسجين فيها يساوي (-1).
(ب) مركب فلوريد الأكسجين (OF2) عدد الأكسدة للأكسجين فيه هو (+2) لأن السالبية الكهربائية للفلور أعلى من الأكسجين.
(جـ) مركب سوبر أكسيد البوتاسيوم (KO2) عدد الأكسدة للأكسجين فية هو (1/2-) .
(7) عدد الأكسدة لعناصر المجموعة الفلزية (1A) (الفلزات القوية ) في مركباته تساوي (+1). ومن أمثلة الفلزات القلوية : (Rb-K-Na-Li)
(8) عدد الأكسدة لعناصر المجموعة السابعة ( الهالوجينات) غالباً تساوي (-1) ومن أمثلة الهالوجينات : (F-Cl-Br-I). أما إذا ارتبط الهالوجين بذرات ذات سالبية كهربية أعلى منه مثل الأكسجين فإن عدد أكسدة الهالوجين سوف يأخذ عدد أكسدة موجب
مثل : Cl2O عدد أكسدة الكلور = +1 ، HClO3 عدد أكسدة الكلور = +5
تمرين محلول:

كتب / مراجع مهمة فى أعداد التأكسد
(1) كتاب مبادئ الكيمياء العامة (نظري + مسائل محلولة) ص193
(2) الكتاب الشامل فى الكيمياء العامة باللغة العربية الفصل التاسع / الأكسدة والأختزال - أعداد الأكسدة ص 1600