الأملاح شحيحة الذوبان فى الماء
- هى الأملاح التى عند إذابتها فى الماء فأن كمية ضئيلة جداُ منها يذوب فى الماء والباقي يترسب.
- حاصل الإذابة Ksp للملح شحيح الذوبان يعتبر مقياسا لقابلية ذوبان الملح في الماء:
(1) كلّما ازدادت قيمة حاصل الإذابة كلّما كانت قابلية الملح للذوبان أكبر.
(2) كلما نقصت قيمة حاصل الإذابة كانت قابلية الملح للترسُّب أكبر.
ذوبانية الأملاح
- لتعيين ذوبانية الأملاح الشديدة الذوبان: يتمّ تحديد كمية الملح المذابة من الملح الشديد الذوبان من معرفة تركيز هذا الملح في المحلول المائيّ.
- لتعيين ذوبانية الأملاح الشحيحة الذوبان: يتمّ تحديد كمية الملح المذابة من الملح الشحيح الذوبان اعتماداً على حاصل الإذابة Ksp
حاصل الإذابة Ksp Solubility Product
- لكل نظام في حالة اتزان يوجد له ثابت الاتزان ksp خاص بالاملاح شحيحة الذوبان.
- عند إذابة ملح شحيح الذوبان فى الماء ، فإنه يحدث اتزان بين الملح غير الذائب وأيونات الجزء الذائب من الملح.
- الجزء الذائب يتفكك كلياً إلى أيوناته ويقال فى هذة الحالة أنه لدينا أتزان غير متجانس بين الأيونات فى المحلول والملح غير الذائب (الصلب).
- عند إضافة ملح كلوريد الفضة AgCl شحيح الذوبان إلى الماء فإن جزءاُ منه يذوب ، وتنشأ حالة اتزان بين الملح غير الذائب والجزء المذاب من الملح ، والذي يتفكك كلية إلى أيوناته وهكذا تنشأ حالة الأتزان بين الأيونات الناتجة من تفكك الجزء الذائب من الملح وهى أيونات -Ag+ , Cl مع الملح غير الذائب وفق المعادلة التالية:
-AgCl(s) ↔ AgCl(dissolve) ↔ Ag+ + Cl
- وعلى هذا فأن (AgCl(dissolve لا وجود له حقيقة لأنه بمجرد حدوث الذوبان يحدث التفكك ويمكن تمثيل المعادلة كالتالي:
-AgCl(s) ↔ Ag+ + Cl
- يمكن التعبير عن ثابت الاتزان (حاصل الإذابة) في هذة الحالة كما يلي:
[-Ksp = [Ag+] [Cl
- كل مادة شحيحة الذوبان في الماء لها ثابت حاصل ذوبان خاص بها.
- الملح الذي له قيمة Ksp أقل هو الذي يترسب اولأ أي انه اذا كانت قيمة Ksp منخفضة دلالة على ان قابلية الذوبان للملح منخفضة.
- حاصل الإذابة Ksp لملح شحيح الذوبان يعرف بأنه مقدار ثابت عند درجة الحرارة الثابتة وهو عبارة عن حاصل ضرب تركيزات الأيونات (مرفوعاً لأس عددها) الناتجة من الملح والموجودة في حالة اتزان مع الملح غير الذائب (الصلب) في محلوله المشبع.
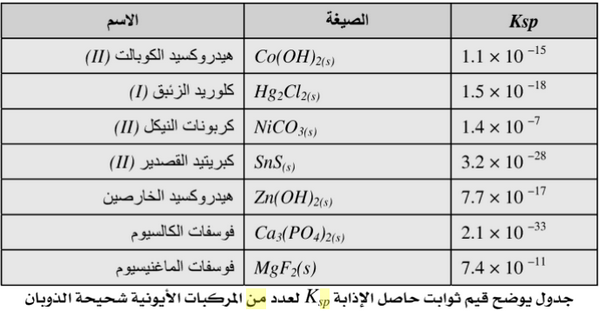
- الجدول التالي يوضح حاصل الإذابة لبعض الأملاح شحيحة الذوبان
أهمية حاصل الإذابة فى عمليات الترسيب
- عند إضافة محلول نترات الفضة إلى محلول كلوريد الصوديوم فأنه يتكون راسب من كلوريد الفضة AgCl (ملح شحيح الذوبان فى الماء) حسب المعادلة التالية:
↓ AgNO3 + NaCl → AgCl + NaNO3
- ولكي يتكون هذا الراسب فأنه لابد أن يكون حاصل ضرب تركيز ايون الفضة [+Ag] فى تركيز أيون الكلوريد [-Cl] أكبر من حاصل الإذابة لملح كلوريد الفضة أى أنه إذا كان الحاصل الأيوني [-Ag+] [Cl] أكبر من حاصل الإذابة Ksp لكلوريد الفضة ، فأنه يحدث ترسيب لكلوريد الفضة.
- أما إذا كان الحاصل الأيوني [-Ksp = [Ag+] [Cl لكلوريد الفضة فانه لا يحدث ترسيب وإنما يكون لدينا محلول مشبع بملح كلوريد الفضة وهو فى الوقت نفسه لا يقبل إذابة مزيد من هذا الملح (تنشأ حالة إتزان).
- أما إذا كان الحاصل الأيوني [-Ksp > [Ag+] [Cl لكلوريد الفضة فانه لا يحدث ترسيب وإنما يكون لدينا محلول غير مشبع من ملح كلوريد الفضة وبالتالي يقبل إذابة مزيد من هذا الملح (أى يحدث ذوبان).
ويمكن تلخيص ما سبق فيما يلي:
(1) إذا كان الحاصل الأيوني < Ksp فأنه يكون لدينا محلول غير مشبع ولا يحدث ترسيب (يحدث ذوبان).
(2) إذا كان الحاصل الأيوني > Ksp فأنه يكون لدينا محلول فوق مشبع ويحدث ترسيب.
(3) إذا كان الحاصل الأيوني = Ksp فأنه يكون لدينا محلول متزن ولا يحدث ترسيب.
منع عملية الترسيب للأملاح شحيحة الذوبان
لمنع عملية ترسيب ملح شحيح الذوبان فإنه يلزم إضافة قليل من مادة تساعد على خفض تركيز أحد الأيونات بحيث لا يمكن الوصول إلى قيمة حاصل الإذابة للملح شحيح الذوبان.
مثال للتوضيح
لا تؤدي إضافة H2S إلى ترسيب FeS من محلول حمض قوي (HCl) يحتوي على أيونات Fe+2 وذلك لأن كمية +H الناتجة من حمض الهيدروكلوريك تمنع تأين H2S (نتيجة تأثير الأيون المشترك) وبذلك تقلل من [-S2-] إلى درجة لا تسمح بالوصول إلى قيمة حاصل إذابة FeS.