الأس الهيدروجينى / الرقم الهيدروجيني pH
- أقترح العالم الدنماركي سروين سورينين Soren Sorensen طريقة عملية تدعى pH
- pH هو اللوغارتيم السالب لتركيز أيونات الهيدروجين
[+pH = - log [H
H+] = 10-pH]
- تم اختيار اللوغارتيم السالب لكي يعطي أرقاماً موجبة لقيم pH والإ فأن قيم [+H] الصغيرة ستكون سالبة.
- لاحظ أن:
pH + pOH = 14
- ولأن pH طريقة بسيطة للتعبير عن تركيز أيون الهيدروجين . إذن يمكن تمييز المحاليل الحمضية والقاعدية عند 25Co من قيم pH كما يأتي:

pH meter
- الأس الهيدروجيني pH يمكن أن يقاس كهروكيميائياً بجهاز يسمى مقياس pH
- صورة الجهاز:

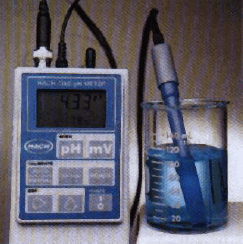
- يتكون هذا الجهاز من قطبتين:
(1) قطب الزجاج
- القطب الزجاجي المستخدم لنصف التفاعل Ag/AgCl مغموراً في محلول HCl المعلوم التركيز.
- فى نهاية هذا القطب الكاشف غشاء زجاجي رقيق جداًوهو حساس لتركيز أيونات الهيدروجين.
(2) قطب الكالوميل المشبع
- قطب الكالوميل هنا هو قطب مرجعي .
- يتكون من سلك البلاتين (Pt) مغموراً في عجينة من كلوريد الزئبقوز (Hg2Cl2) وسائل الزئبق ومحلول KCl المشبع.
- غشاء القطب الزجاجي يقيس تركيز أيونات الهيدروجين للمحلول منسوباً إلى تركيز أيونه الهيدروجينى الداخلي.
- الفرق في الجهد بين كلاً القطبين يحول إلكترونياً ليعطى pH للمحلول تبعاً للمعادلة:
Ecell = 0.0592 pH
- التفاعل الكلي الذي يحدث فى الخلية:
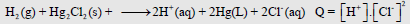
- جهاز قياس pH الذي يستخدم فى المختبرات لقياس pH المحلول ، وعلى الرغم من أن الكثير من أجهزة قياس pH تحتوي على مقاييس لقيم pH من 1 إلى 14 فإن pH قد تقل عن 1 وتزيد على 14.
مثال: أحسب تركيز أيون الهيدروجين لمحلول له pH =3.66
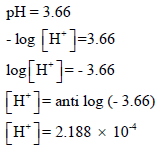
أهمية قياس pH
(1) معرفة الأحماض والقواعد
(2) التطبيقات الطبية المتعددة.
(3) قياس pH في الأمطار الحمضية.
ملخص القوانين المستخدمة لحساب تراكيز أيونات الهيدروجين والهيدروكسيل فى مختلف المحاليل.

كما يمكنك قراءة هذا الموضوع من موقع/ تعرف على علم الكيمياء:
ملخص رائع لقوانين pH الرقم الهيدروجيني