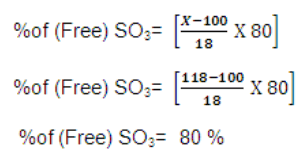الفرق بين حمض الكبريتيك المركز والمدخن
أولاُ/ حمض الكبريتيك المركز
- هو حمض خالي من مجموعة SO3
- تركيزه يصل إلى 96% w/w
- رمزه الكيميائي H2SO4
- يعين تركيزه بالمعايرة مع قلوي قوي مثل : الصودا الكاوية .
ثانياُ/ حمض الكبريتيك المدخن أو الأليوم (oleum)
- هو حمض كبريتيك يحتوى على مركب ثالث أكسيد الكبريتSO3 ذائب فيه .
- رمزه الكيميائي H2SO4.xSO3 .
- يصل تركيز SO3 إلى 20% - 40% بينما يصل تركيز حمض الكبريتيك فيه إلى 103% - 106% .
- ولا يفضل تعيين تركيزه بالمعايرة التقليدية مع الصودا . لأنه يعطي نتائج غير دقيقة .
- حيث أن تفاعل الحمض مع الصودا ينتج ملح وماء الذي يتفاعل مع مجموعة الـ SO3 الموجودة ويكون حمض كبريتيك من جديد وهكذا ...
حمض الكبريتيك المدخن fuming sulfuric acid
- يعرف أيضاً بالأوليوم Oleum
- يمكن كتابة صيغة الأوليوم على الشكل H2SO4·xSO3
- حيث تمثل (x) المحتوى المولي ( الكسر المولي) من ثالث أكسيد الكبريت الحر؛ كما يمكن التعبير عن ذلك المحتوى الحر بالكتلة.
- كما يمكن التعبير عن الأوليوم بالصيغة ySO3·H2O، حيث (y) الكتلة المولية الكلية لمحتوى ثلاثي أكسيد الكبريت المنحل.
- عندما تكون x = 1 أو y = 2 تكون الصيغة المجملة H2S2O7، وهي الصيغة الكيميائية لحمض ثنائي الكبريتيك.
العلاقة بين نسبة الحمض ونسبة الاوليوم
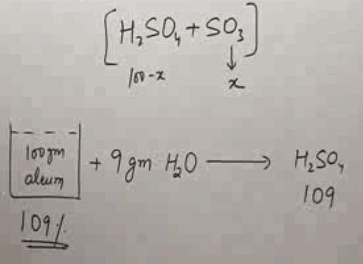
- يمثل تركيز الأوليوم عادة بالصيغة % (100 + X) مثل 104% و 109% و 118% وهكذا.
- (X) هي كمية الماء بالجرامات اللازمة للاتحاد مع SO3 الحر الموجود فى 100 جرام من الأليوم.
- مثلاُ: 109% Oleum تعنى 100 جرام من الأوليوم + 9 جرام من الماء
وتعنى أن 9 جرام من الماء كافية للأتحاد مع SO3 الحر الموجود فى 100 جرام من عينة حمض الكبريتيك المدخن.
- العلاقة بين نسبة الحمض ونسبة الاوليوم تعطى من القانون التالي:
% acid% = 100 + 18/80 × oleum
مثال: أحسب نسبة حمض الكبريتيك الموجودة فى عينة 10% أوليوم
بالتعويض فى القانون السابق نجد أن:
% acid% = 100 + 18/80 × 10
% acid% = 102.25
حساب نسبة SO3 الحر الموجود فى الأوليوم
نستخدم العلاقة التالية :
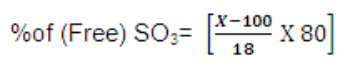
حيث (X) هو نسبة الأوليوم الموجودة على العينة
مثال: أحسب نسبة SO3 الحر الموجود فى عينة من الأوليوم 118%