ترتيب الأيونات في بلورات كلوريد الصوديوم (NaCl)
- تتكون بلورات كلوريد الصوديوم الصلبة (NaCl) من أيونات الصوديوم (+Na) وأيونات الكلوريد (-Cl) متماسكة معًا في نظام ثلاثي الأبعاد متكرر يسمى الشبكة البلورية (Lattice) .
- في النظام الثلاثي الأبعاد ، كل أيون صوديوم محاط بستة أيونات كلوريد وكل أيون كلوريد محاط بستة أيونات صوديوم.
- لذلك فأن رقم التناسق لأيونات الصوديوم هو (6) ورقم التناسق لأيونات الكلوريد (6) .
- فيما يلي عرض ثنائي الأبعاد لشبكة بلورية NaCl
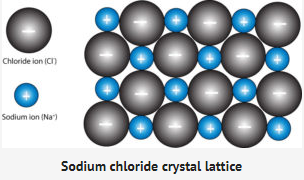
- من وجهة النظر ثنائية الأبعاد ، من المضلل الاعتقاد بأن كل أيون صوديوم محاط بأربعة أيونات كلوريد وكل أيون كلوريد محاط بأربعة أيونات صوديوم. إذا كنت تعتقد أن العرض ثنائي الأبعاد موجود في مستوى الورقة ، ففي المنظر ثلاثي الأبعاد ، سيكون لديك أيون آخر يشير إلى الخارج نحوك ، وآخر يشير للخلف بعيدًا عنك. إذا أضفت الأيونات بشكل تخيلي إلى الأيونات الأربعة المحيطة بكل أيون ، فستحصل على ستة.
رقم التناسق لكل من أيونات الصوديوم وأيونات الكلوريد co-ordination number
- رقم التناسق أو العدد التناسقي أو العدد التساندي في علم الكيمياء وعلم المعادن هو عبارة عن مجموع الذرات المجاورة لذرة مركزية في مركب كيميائي وعدد أزواج الإلكترونات المفردة فيها . فمثلاً الميثان يكون الرقم التناسقي للكربون (4).
- كما بالشكل يحاط كل أيون كلوريد -Cl بستة أيونات صوديوم +Na لذلك رقم التناسق لأيون الكلوريد هو (6)

- كما بالشكل يحاط كل أيون صوديوم +Na بستة أيونات كلوريد -Cl لذلك رقم التناسق لأيون الصوديوم هو (6)

وعلى ذلك يكون النسبة بين رقم التناسق لأيون الصوديوم إلى رقم التناسق لأيون الكلوريد = 6 : 6 = 1 : 1
وعلى ذلك تكون الصيغة Na1Cl1 أي NaCl ويكون الجزئ متعادل.
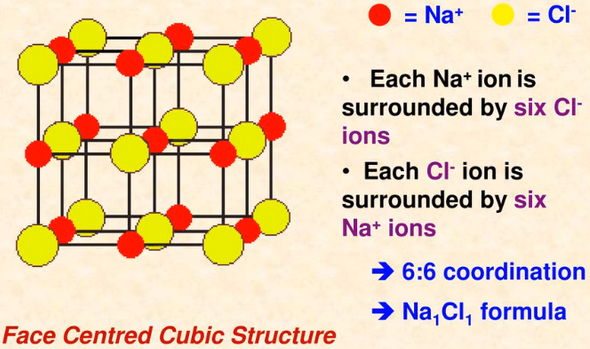
الشكل النهائي لبلورات كلوريد الصوديوم
