نظريات سرعة التفاعل
لقد تم وضع عدد من النظريات لتفسير كيفية حدوث التفاعل الكيميائي.
- أهم هذة النظريات نظريتان هما نظرية التصادم ، نظرية الحالة الانتقالية (نظرية المعقد المنشط).
- فسرت نظرية التصادم كيفية حدوث التفاعل على الاساس الظاهري للعيان أما نظرية المعقد المنشط ففسرت حدوث التفاعل الكيميائي بطريقة ما يحدث داخل الجزيئات عند خضوعها لتفاعل.
نظرية الحالة الانتقالية
- تعرف أيضاَ بنظرية المعقد المنشط Activated complex theory
- بينت هذة النظرية أنه فى جميع التفاعلات الكيميائية لا يمكن أن تتكون المواد الناتجة مباشرة بل لابد أن تمر بما يسمى بالحالة الانتقالية النشطة وهي التى يتكون عندها المعقد النشط Activated complex.
- المعقد النشط هو مركب نشط غير ثابت أقترح بأن تركيبه وسطاً بين المواد المتفاعلة والمواد الناتجة ويكون فى حالة توازن مع المواد المتفاعلة. (لذلك تسمى النظرية بنظرية المعقد المنشط).
- طاقة المعقد النشط أكبر دائماُ من طاقة المواد المتفاعلة والناتجة .
- لا يمكن فصل المعقد المنشط فى الغالب ولكنه يمكن أن يتفكك أما لإعطاء النواتج أو لإعطاء المواد المتفاعلة حسب ظروف التفاعل.
مثال توضيحي على نظرية المعقد المنشط
من الأمثلة المهمة لتوضيح فكرة نظرية التصادم ونظرية المعقد المنشط هي التفاعل الحاصل بين أيون اليوديد -I وكلوريد الميثيل CH3Cl

- يحدث التفاعل حسب الطريقة الموضحة فى الشكل التالي:
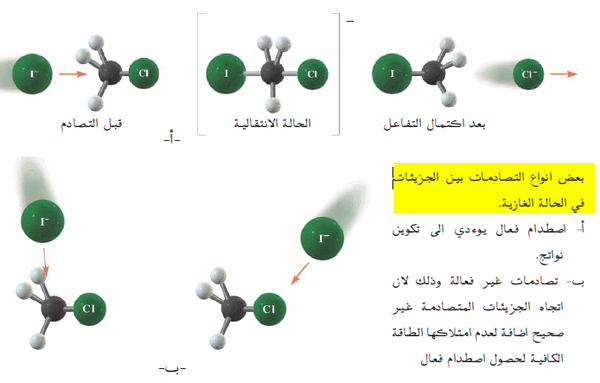
- يبدأ التفاعل باصطدام آيون اليوديد -I مع جزئ كلوريد الميثيل CH3Cl من خلال الأصرة C-Cl من خلال وسط ذرات الهيدروجين الثلاث، حيث تبدأ نشوء الرابطة بين الكربون واليود بينما تستطيل وتضعف الرابطة بين الكربون والكلور وتتكون الحالة الأنتقالية للتفاعل ( المعقد المنشط)
- يحتوى المعقد المنشط على ثلاث روابط اعتيادية C-H وارتباطتين ضعيفين (روابط جزئية) بين الكربون واليود C-I والكربون والكلور C-Cl وبزيادة قوة الارتباط بين الكربون واليود تنشأ الرابطة بينهما، بينما تنكسر الرابطة بين الكربون والكلور فينفصل أيون الكلوريد ويتم التفاعل [الشكل (أ)].
- أما أذا كان التصادم بين آيون اليوديد وجزئ كلوريد الميثيل في الاتجاه غير الصحيح فعندها تبقى المواد المتفاعلة على ما هي عليه ولا يحدث التفاعل [الشكل (ب)].
المعقد النشط Activated Complex
- هي حالة انتقالية غير مستقرة من تجمع الذرات يحدث خلالها تكسير الروابط وتكوين روابط جديدة. ونتيجة لذلك قد يؤدي المعقد المنشط إلى تكوين المواد الناتجة، أو يتكسر لتكوين المواد المتفاعلة مرة أخرى.
- طاقة التنشيط Ea) Activation energy) هي الحد الأدني من الطاقة لدى الجزئيات المتفاعلة واللازم لتكوين المعقد النشط وإحداث التفاعل.
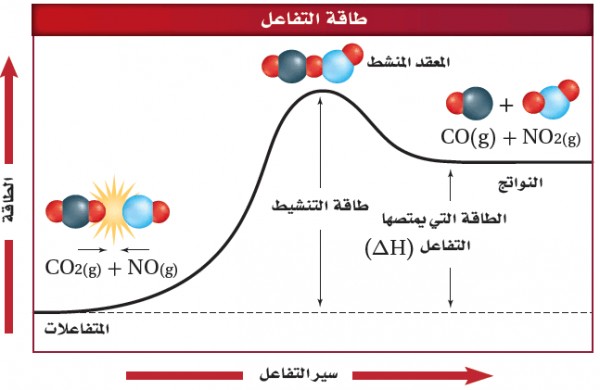
(1) فى حالة التفاعل الطاردة للحرارة
- يبين المخطط التالي طاقة التنشيط للتفاعل التى تعد حاجزاُ أمام حدوث التفاعل ، لذلك يجب أن تتغلب المواد المتفاعلة عليه لتكون مواد ناتجة.
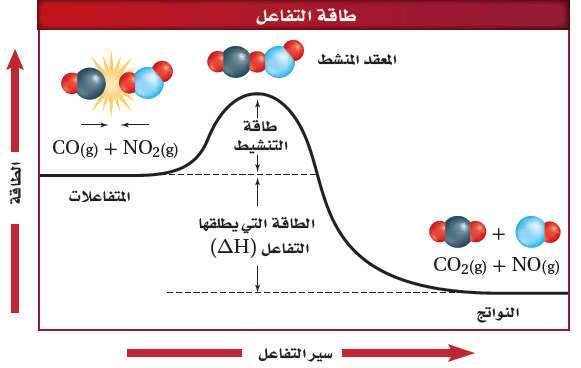
- وفى هذة الحالة تتصادم جزئيات CO , NO2 مع وجود كمية كافية من الطاقة لتتغلب على هذا الحاجز وتكون طاقة النواتج أقل من طاقة المتفاعلات .
الخلاصة
عندما يحدث تفاعل طارد للحرارة تصطدم الجزئيات التى لها طاقة كافية فتكون المعقد النشط وتطلق طاقة وتكون نواتج ذات محتوى طاقة أقل من المواد المتفاعلة.
- طاقة المعقد النشط أكبر من طاقة المتفاعلات وطاقة النواتج.
(2) في حالة التفاعل الماص للحرارة
- تكون طاقة جزيئات المتفاعلات فى التفاعل العكسي الماص للحرارة أقل من طاقة النواتج .
- لكى يحدث التفاعل يجب أن تمتص المتفاعلات طاقة لتتغلب على طاقة التنشيط وتكون نواتج ذات طاقة عالية.
- طاقة المعقد النشط أكبر من طاقة المتفاعلات وطاقة النواتج.