نظرية التصادم Collision Theory
- فى التفاعل الكيميائي يجب أن تتصادم جزئيات المواد المتفاعلة لتكوين النواتج.
- يمثل الشكل التالي التفاعل بين جزئيات A2 , B2 لتكوين AB.
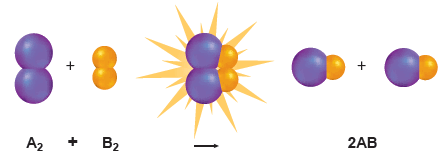
- يجب أن تتصادم جزيئات المواد المتفاعلة معاً لتكوين جزئيات AB.
- لذا يوضح الشكل نظرية التصادم التى تنص على وجوب تصادم الذرات والأيونات والجزيئات بعضها ببعض لكي يتم التفاعل.
اتجاه التصادم وتكوين المعقد النشط
- فى تفاعل غاز أول أكسيد الكربون CO مع غاز ثاني أكسيد النيتروجين NO2 الذي يحدث عند درجة حرارة أعلى من 500K.
- تتصادم جزيئات المواد المتفاعلة لإنتاج غاز ثاني أكسيد الكربون وغاز أول أكسيد النيتروجين.
- عند حساب عدد الاصطدامات بين الجزيئات في كل ثانية تكون النتيجة محيرة ؛ إذ يكوِّن قليل فقط من هذه الاصطدامات نواتج.
- يبين الشكل التالي أربعة احتمالات لاتجاهات التصادم بين جزئيات CO , NO2
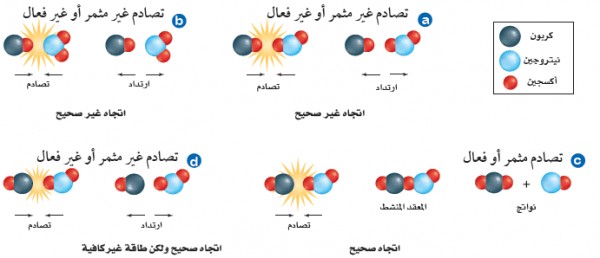
(1) لا تؤدي التصادمات فى كل من الحالتين (a) , (b) إلى حدوث التفاعل لأن الجزئيات لا تسطيع تكوين روابط لأنه لكى يؤدي الاصطدام إلى حدوث تفاعل يجب أن ترتبط ذرة الكربون من جزئ CO مع ذرة أكسجين من جزئ NO2 فى لحظة الاصطدام وهذه هي الطريقة الوحيدة لتتكون رابطة مؤقتة ولكن الحالتين (a), (b) الجزئيات تتصادم بشكل غير مناسب حيث لا تلامس ذرة الكربون ذرة الأكسجين في لحظة التصادم فترتد الجزيئات دون تكوين روابط.
(2) فى الشكل (C) يكون اتجاة الجزيئات مناسباً أثناء التصادم حيث يحدث التفاعل وتنتقل ذرة اكسجين من جزئ NO2 إلى جزئ CO وعندما يحدث ذلك تتكون جسيمات عمرها قصير تسمى المعقد النشط Activated Complex
(3) فى الشكل (d) لا يؤدي التصادم إلى تفاعل لعدم توافر طاقة كافية لحدوق التفاعل للك لا يحدث تفاعل بين جزئيات CO , NO2 مالم تتصادم بقوة كافية. ويسمى الحد الأدني من الطاقة لدى الجزئيات المتفاعلة واللازم لتكوين المعقد النشط وإحداث التفاعل بطاقة التنشيط Ea) Activation energy)
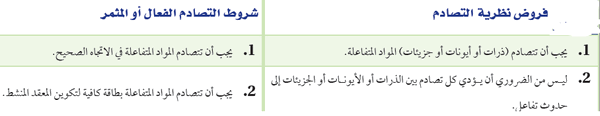
الخلاصة: الجدول التالي يوضح فروض نظرية التصادم وشروط التصادم الفعال أو المثمر:
المعقد النشط Activated Complex
- هي حالة انتقالية غير مستقرة من تجمع الذرات يحدث خلالها تكسير الروابط وتكوين روابط جديدة. ونتيجة لذلك قد يؤدي المعقد المنشط إلى تكوين المواد الناتجة، أو يتكسر لتكوين المواد المتفاعلة مرة أخرى.
- طاقة التنشيط Ea) Activation energy) هي الحد الأدني من الطاقة لدى الجزئيات المتفاعلة واللازم لتكوين المعقد النشط وإحداث التفاعل.
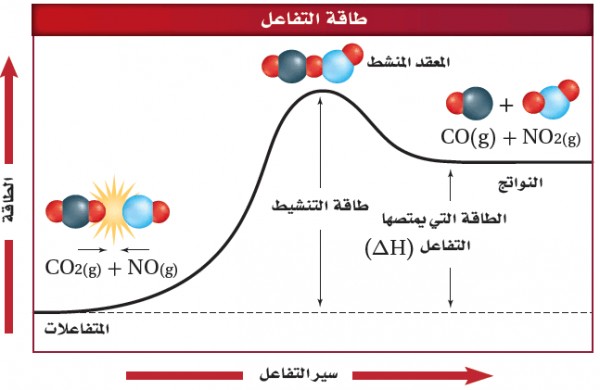
(1) فى حالة التفاعل الطاردة للحرارة
- يبين المخطط التالي طاقة التنشيط للتفاعل التى تعد حاجزاُ أمام حدوث التفاعل ، لذلك يجب أن تتغلب المواد المتفاعلة عليه لتكون مواد ناتجة.
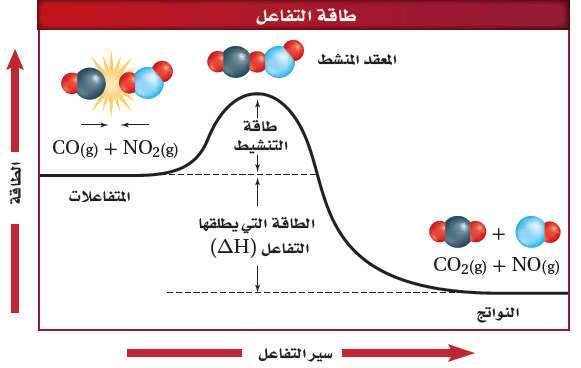
- وفى هذة الحالة تتصادم جزئيات CO , NO2 مع وجود كمية كافية من الطاقة لتتغلب على هذا الحاجز وتكون طاقة النواتج أقل من طاقة المتفاعلات .
الخلاصة
عندما يحدث تفاعل طارد للحرارة تصطدم الجزئيات التى لها طاقة كافية فتكون المعقد النشط وتطلق طاقة وتكون نواتج ذات محتوى طاقة أقل من المواد المتفاعلة.
- طاقة المعقد النشط أكبر من طاقة المتفاعلات وطاقة النواتج.
(2) في حالة التفاعل الماص للحرارة
- تكون طاقة جزيئات المتفاعلات فى التفاعل العكسي الماص للحرارة أقل من طاقة النواتج .
- لكى يحدث التفاعل يجب أن تمتص المتفاعلات طاقة لتتغلب على طاقة التنشيط وتكون نواتج ذات طاقة عالية.
- طاقة المعقد النشط أكبر من طاقة المتفاعلات وطاقة النواتج.