أولاً/ ترتيب المستويات الفرعية
- تترتب المستويات الفرعية حسب ازدياد طاقتها من اليسار إلى اليمين وعلى النحو المبين أدناه:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 4p 6s 4f 5d 6p 7s 5f 6d 7p
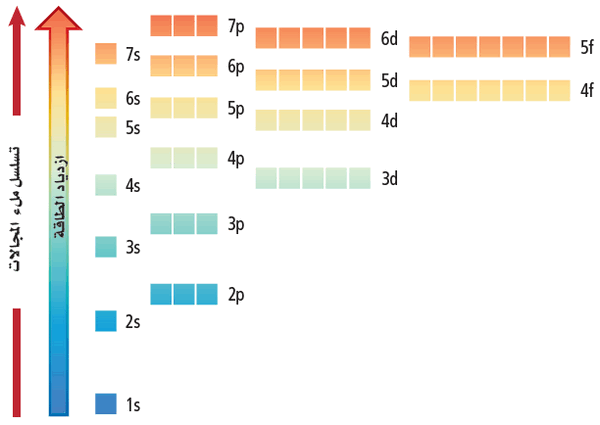
- على الرغم من أن المستويات الفرعية أعلاه لا تترب ترتيباً رقمياً (مثال 4s يتقدم على 3d أي 3d أكثر طاقة من 4s على الرغم من أن المستوى الرئيسي الرابع هو أبعد عن النواة من المستوى الرئيسي الثالث) إلا أنه يمكن تذكر تسلسل المستويات الفرعية وذلك من خلال تطبيق قاعدة (n+L).
ثانياً/ كيف يمكن معرفة مستويات الطاقة الفرعية الأقل والأعلى فى الطاقة؟
- من خلال تطبيق قاعدة ( n+l) والتي تنص على أن طاقة الأغلفة الثانوية تزداد كلما ازدادت قيمة ( n+l) وإذا تساوت قيمة (n+l) لغلافين ثانويين أو أكثر فأقلها طاقة ما له اقل قيمة عددية لعدد الكم الرئيسي (n)
حيث (n) : عدد الكم الرئيسي ، (l) : عدد الكم الثانوي
- يمكنك استخدام الجدول التالي فى معرفة قيمة n , l
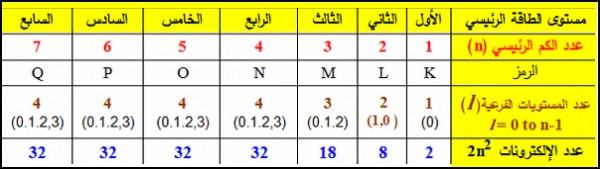
ويكون عدد الكم الثانوي (l) للأغلفة s,p,d,f كالتالي:

مثال (1): أيهما أكثر طاقة 3s أو 3P؟
- يتضح من خلال استخدام القاعدة (n+l)
3s = 3 + 0 = 3
3p = 3 + 1 = 4
وبما أن القيمة أكبر فى حالة 3p عنها فى حالة 3s فأن 3p أعلى فى الطاقة من 3s
أو بتعبير آخر الغلاف 3s يتقدم الغلاف 3p في سلسلة الأغلفة الثانوية أعلاه ويمتلئ بالألكترونات أولاً.
مثال (2): أيهما أكثر طاقة من بين الأغلفة (6s , 4d , 5p) حيث أن قيمة (n+L) لكل منها تساوي 6 ؟
بتطبيق القاعدة ( n+l) يكون:
6s = 6 + 0 = 6
5p = 5 + 1 = 6
4d = 4 + 2 = 6
- حسب ما جاء بالجزء الثاني من قاعدة (n+l) فإن طاقة المستويات الفرعية تترتب حسب عدد الكم الرئيسي (n) فأقلها طاقة أقلها فى عدد الكم الرئيسي.
- الغلاف (6s) هو أكثر هذه الأغلفة طاقة أو يمكن ترتيب هذه الأغلفة كما هو موضح بالشكل التالي:

إجابة السؤال: (أ) حدد أى مستوى فرعي له الطاقة الأكبر 4f أم 5s ؟ ولماذا؟
- نستخدم قاعدة (n+L) السابقة
- القيمة العددية لعدد الكم (L) لكل من المستويات الفرعية (s, p , d , f) هي 3 , 2 , 1 , 0 على الترتيب.
- القيمة العددية لعدد الكم الرئيسي (n) هو العدد الموجود قبل رمز المستوى الفرعي.
(1) المستوى الفرعي (5s)
n + L = 5 + 0 = 5
(2) المستوى الفرعي (4f)
n + L = 4 + 3 = 7
وحسب قاعدة (n + L) فأن طاقة المستويات الفرعية تزداد كلما ازدادت قيمة (n+L) وعليه يكون:
5s < 4f
إجابة السؤال: (ب) لماذا يشغل إلكترون واحد في ذرة الروبيدوم Rb37 فلك 5s بدلاً من 4d أو 4f
التوزيع الإلكتروني للروبيدوم
Rb37 : 1s2 , 2s2 2p6 , 3s2 3p6 , 4s2 3d10 4p6 , 5s1
لأن حسب مبدأ البناء التصاعدي (مبدأ أوفباو) على أنه:
"لابد للإلكترونات أن تملأ المستويات الفرعية ذات الطاقة المنخفضة أولاً ثم المستويات الفرعية ذات الطاقة الأعلي"
حيث تكون طاقة المستوى الفرعي 5s أقل من طاقة المستوى الفرعي 4f أو 4d لذلك يتم ملئ 5s أولاً.