الهيدروجين الحمضي Acidic hydrogen
- الهيدروجين الحمضي هو أى ذرة هيدروجين مرتبطة بمجموعة أو ذرة ساحبة للألكترونات.
- الحامضية تعنى سهولة فقد أيونات الهيدروجين من المركب.
- تعمل الذرة أو المجموعة الساحبة للألكترونات على سحب الألكترونات نحوها من ذرة الهيدروجين وبالتالي يزداد طول الرابطة بين الهيدروجين والذرة الساحبة للألكترونات حتى يتم كسرها بسهولة وتخرج أيونات الهيدروجين.
- كلما ازداد سهولة خروج أيونات الهيدروجين من المركب كلما أصبحت أيونات الهيدروجين أكثر حامضية.
- يكون الهيدروجين الحمضى أكثر حامضية كلما ارتبط بذرات أكبر فى السالبية كهربية.
- الهيدروجين الحمضى يكون أكثر حامضية إذا كان خروج ذرة الهيدوجين تؤدي إلى حدوث رنين ، فى الشكل المقابل يكون الهيدروجين الحمضى رقم (1) اكثر حامضية من الهيدروجين الحمضي رقم (2) لأن خروج +H يؤدى إلى حدوث رنين
حل السؤال
- فى السؤال جميع ذرات الهيدروجين الموجودة فى المركب هى هيدروجين حمضي ولكن تختلف فى أيهما هو أكثر حامضية Most acidic hydrogen
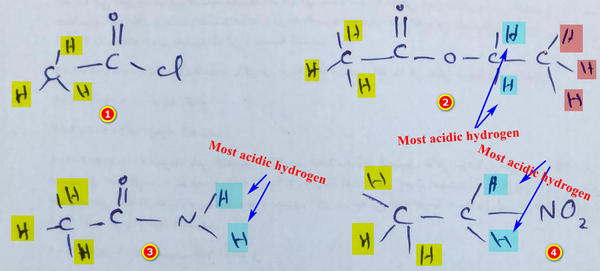
- الهيدروجين حمضى الموجود على الجزئ رقم (3) هو الأكثر وضوحاً لأنه الوحيد الذى ترتبط فيه ذرات الهيدروجين مباشرة بذرة لها سالبية كهربية عالية وهى النيتروجين على عكس المركبات الأخرى.
- فى الجزئ رقم (1) كل ذرات الهيدروجين متكافئة فى الحامضية.
- فى الجزئ رقم (2) ذرات الهيدروجين الملونة باللون الازرق السماوي هى الأكثر حامضية لأنها الاقرب لذرة الأكسجين ذات السالبية الكهربية العالية وخروج H من هذا المكان يؤدى الى تكون كثافة ألكترونية على ذرة الأكسجين ويحدث الرنين مع مجموعة الكربونيل المجاورة.
- فى الجزئ رقم (3) ذرات الهيدروجين الملونة باللون الازرق السماوي هى الأكثر حامضية لانها متصلة مباشرة ودون فواصل مع ذرة النيتروجين ذات السالبية الكهربية العالية.
- فى الجزئ رقم (4) ذرات الهيدروجين الملونة باللون الازرق السماوي هى الأكثر حامضية لأنها الاقرب للمجموعة الساحبة للألكترونات NO2
التأثير الميزوميري Mesomeric effect
- كان الكيميائي كريستوفر كيلك إنغولد أول من طرح مبدأ التأثير الميزوميري وذلك سنة 1938 بديلاً عن مبدأ الرنين المرادف الذي طرحه لينوس باولنغ.
- هو القطبية الناتجة فى الجزي بواسطة التأثير المتبادل بين رابطتين من النوع (π) أو بين رابطة من النوع (π) وزوج مفرد من الألكترونات الموجود على ذرة مجاورة.
- يحدث بكثرة فى حالات الروابط الثانئية (double bond) حيث يتضمن عدم تمركز ألكترونات الرابطة (π)
- هو خاصية توجد لدى المستبدلات أو المجموعات الوظيفية في المركبات الكيميائية يمكن بموجبها إجراء توصيف نوعي لمدى مقدرة سحب الإلكترونات أو مانحة للإلكترونات اعتماداً على التركيبات الرنينية الموافقة conjugated structures
- يرمز لهذه الخاصية بالحرف M
التاثير الميزوميري السالب والموجب (M , +M-)
- يكون التأثير الميزوميري إيجابي (+M) عندما يكون المستبدل مانحاً للإلكترونات.
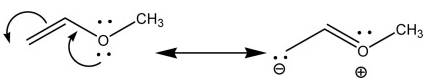
- في حين أن التأثير السلبي (–M) يكون للمجموعات الساحبة للإلكترونات.
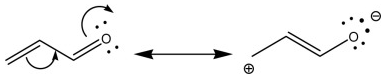
- الجدول التالي يوضح المستبدلات ذات التأثير الأيجابي أو السلبي
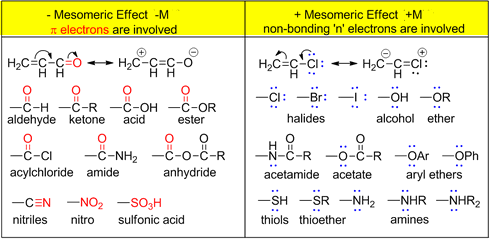
- ترتيب المستبدلات ذات التأثير الميزوميري الإيجابي (+M)
O− > –NH2 > –NHR > –OR > –NHCOR > –OCOR > –Ph > –F > –Cl > –Br > –I–
- ترتيب المستبدلات ذات التأثير الميزوميري السلبي (-M)
−NO2 > –CN > -SO3H > –CHO > –C=O > –COOCOR > –COOR > COOH > -COCl >–CONH2 > –COO–
أنظر الى المجموعات الملونة باللون الأحمر سنجد أنها نفس المجموعات الوظيفية الموجودة فى المركبات وعليه يكون الترتيب حسب الزيادة فى الحامضية كالتالي:
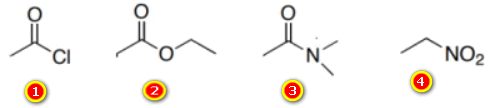
(Molecule (4) > molecule (2) > molecule (1) > molecule (3
ملاحظة هامة : ترتيب العناصر حسب السالبية الكهربية:
O > Cl > N
- الجزئ رقم (4): يحتوى على ثلاث ذرات ذات كهروسالبية عالية غير موجودة فى المركبات الأخري لذا فهى الأعلى فى الحامضية.
- الجزئ رقم (2): يحتوى على ذرتين أكسجين يجعل السالبية الكهربية عالية مقارنة بالجزيئات (1) , (3).
- الجزئ رقم (3) والجزئ رقم (1) كلاُ منهما يحتويان على ذرتين ذات سالبية كهربية عالية ولكن نجد فى الجزئ رقم (1) ذرة الكلور وهي أعلى سالبية كهربية من ذرة النيتروجين لذلك الجزئ رقم (1) أعلى حامضية من الجزئ رقم (3).