الرنين Resonance
- يمكن باستخدام مجموعة الذرات نفسها الحصول على أكثر من تركيب لويس صحيح، وذلك حينما يكون للجزيء أو الأيون المتعدد الذرات روابط أحادية وثنائية في الوقت نفسه.
- الرنين حالة تحدث عندما يكون هناك احتمال لرسم أكثر من تركيب لويس لشكل الجزيء أو الأيون.
- يشار إلى تركيب لويس الصحيح الذي يمثل الجزئ نفسة أو الأيون بأشكال الرنين.
- تختلف أشكال الرنين في مكان وجود أزواج الألكترونات لا في مكان وجود الذرة ، لذا تختلف أماكن الأزواج غير الرابطة وأزواج الروابط في الأشكال.
- لجزئ O3 والأيونات المتعددة الذرات -CO32- ، SO32- ، NO2 أشكال رنين.
- ومن المهم معرفة أن كل جزيء أو أيون له رنين خاص به، يظهر كأن له بناءً واحداً فقط.
أمثلة على مفهوم الرنين
(1) الرنين فى مركب الأوزون O3
- الشكل التالي يوضح تركيب لويس لمركب الأوزون O3
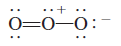
- ولكن فى الواقع يمكننا أن نجعل الرابطة المزدوجة مع أى من طرفي الجزئ مثلما توضح أشكال لويس التالية:

لكن أياً من هذين البناءين لا يتوافق مع اطوال الروابط المعروفة في O3
- من المتوقع أن تكون الرابطة O-O أطول من الرابطة O=O لأن الروابط المزدوجة هي أقصر من الروابط المفردة
- لكن الدلائل العلمية والدراسات أثبتت أن جميع روابط الأكسجين - أكسجين فى الأوزون متساوية فى الطول (128pm) ومن أجل التخلص من هذة المشكلة فأننا نستخدم كلا البنائين لتمثيل جزئ الأوزون:

- يعرف كل من هذين البنائين بأنه بناء رنين (resonance structure)
- شكل الرنين هو واحد أو أكثر من بناءات لويس لجزئ واحد لا نستطيع تمثيله بشكل دقيق عن طريق بناء لويس واحد.
- يدل السهم مزدوج الرأس ↔ أن البناءات هي بناءات الرنين.
- أن تعبير الرنين يعني استخدام بناءي لويس أو أكثر لتمثيل جزئ معين فأننا كذلك نصف الأوزون وهو جزئ حقيقي بدلالة بناءين مألوفين ولكن لا وجود لهما.
- إن الأعتقاد أن جزيئاً مثل الأوزون ينتقل على نحو سريع بين بناء رنين وآخر هو فهم غير صحيح للرنين ويجب ألا يغيب عن الذهن أن أياً من بناءات الرنين لا يمثل الجزئ الحقيقي على النحو المرضي.
(1) أيون الكربونات -CO32
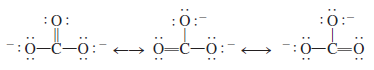
(2) أيون النترات -NO3
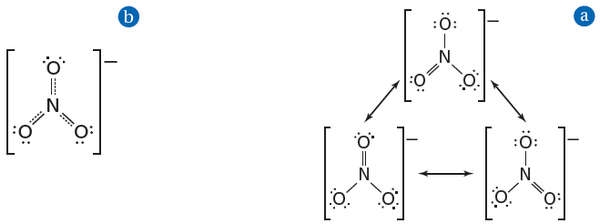
الشكل (a): تختلف اشكال الرنين هذه في مكان الرابطة الثنائية فقط ، ولا تتغير أماكن ذرات النيتروجين والأكسجين
الشكل (b): يكون أيون النترات الحقيقي هو متوسط أشكال الرنين الثلاثة في (a)
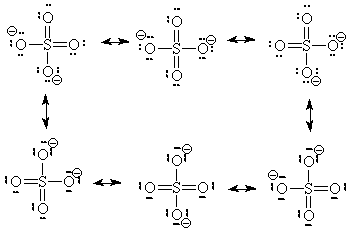
أشكال الرنين في أيون الكبريتات -SO42
- يوجد (6) اشكال رنين لأيون الكبريتات
الرنين فى الكيمياء العضوية
- ينطبق مفهوم الرنين كذلك على الأنظمة العضوية وخير مثال على ذلك جزئ البنزين C6H6
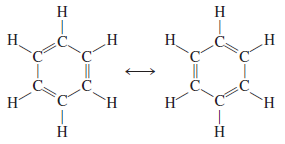
- لو أن أحد هذة البناءات يمثل البناء الحقيقي للبنزين لكان هناك طولان مختلفان للروابط بين ذرات الكربون المتجاورة يدل أحدهما على الرابطة الأحادية والآخر على الرابطة المزدوجة.
- أن المسافة بين ذرات الكربون المتجاورة جميعها فى البنزين هي فى الحقيقة متساوية وتساوي 140pm أى أنها أقصر من رابطة (C-C) والتى طولها (154pm) لكنها أطول من رابطة C=C والتى طولها (133pm)
- هناك طريقة أبسط لرسم بناء البنزين وغيره من المركبات التى تحتوى على حلقة البنزين وهى بأن يظهر الهيكل فقط بدون ذرات الكربون والهيدروجين وإستناداً إلى ذلك فإن بناءات الرنين تمثل بالآتي:
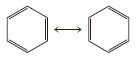
لاحظ أن ذرات الكربون على زوايا الشكل السداسي وذرات الهيدروجين قد حذفت جميعها على الرغم من وجودها والروابط التى يتم إظهارها هي التى بين ذرات الكربون فقط.
ملحوظة هامة
يمكن إعادة توزيع مواقع الإلكترونات (أي الروابط) في بناءات الرنين المختلفة ولكن ليس مواقع الذرات وبتعبير آخر يجب بقاء الذرات نفسها مرتبطة ببعضها في بناءات الرنين دون تغيير أماكنها.
القواعد الهامة للرنين
(1) إن بناءات الرنين ليس لها وجود فعلي لكنها تستخدم لتساعد في وصف الجزئ أو الأيون الذي لا يمثله بناء واحد للويس.
(2) عند كتابة بناءات الرنين يجب تغيير مواقع الإلكترونات فقط دون تغيير مواقع الأنوية .
(3) يجب أن يكون في كل بناء رنيني نفس العدد من الإلكترونات المفردة .
(4) كلما زاد عدد الروابط التساهمية في بناء الرنين كلما كان أكثر ثباتا .
(5) عندما تكون الشحنات على بناء الرنين منفصلة فأن الثبات يقل .
(6) البناء الذي تكون فيه الشحنة السالبة على ذرة أعلى كهروسالبية يكون أكثر ثباتا .
(7) البناء الذي تكون فيه لكل ذرة تركيب الغاز الخامل يكون الأكثر ثباتا .